
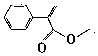
 .下列说法正确的是( )
.下列说法正确的是( )| A. | 阿托酸甲酯在碱性条件下易变质 | |
| B. | 阿托酸(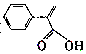 )分子中所有碳原子不可能共平面 )分子中所有碳原子不可能共平面 | |
| C. | 阿托酸甲酯使溴水褪色的反应属于取代反应 | |
| D. | 阿托酸甲酯分子式为C10H8O2 |
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题

| A. | 含有5种官能团 | |
| B. | 分子式为C9H9O6 | |
| C. | 可以发生取代、加成、消去、氧化反应 | |
| D. | 核磁共振氢谱具有6个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有X、Y、Z、W、R、T六种短周期主族元素,它们的原子序数依次增大,W与R同主族,且W的氢化物常温时为液态.X、Y的最外层电子数之和与Z的最外层电子数相等,X分别与Y、Z、W形成电子总数相等的分子.
现有X、Y、Z、W、R、T六种短周期主族元素,它们的原子序数依次增大,W与R同主族,且W的氢化物常温时为液态.X、Y的最外层电子数之和与Z的最外层电子数相等,X分别与Y、Z、W形成电子总数相等的分子.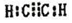 (写电子式).该物质与空气在酸性条件下可构成燃料电池,该电池放电时,负极的反应式为C2H2-10e-+4H2O=2CO2+10H+.
(写电子式).该物质与空气在酸性条件下可构成燃料电池,该电池放电时,负极的反应式为C2H2-10e-+4H2O=2CO2+10H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(3) | B. | (1)(2)(5) | C. | (2)(3)(5) | D. | (2)(4)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.0gNaHSO4晶体中阳离子数为0.2NA个 | |
| B. | 0.1 mol Cu与足量热的浓硫酸反应生成SO2的体积约为22.4 L | |
| C. | T℃时,1L pH=6的纯水中,含1×10-6NA个H+ | |
| D. | 标准状况下,1 L pH=13的NaOH溶液中OH-为0.1NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 将铜丝插入浓硝酸中:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 将过氧化钠投入足量水中:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| D. | (NH4)2Fe(SO4)2溶液与过量Ba(OH)2溶液混合:Fe2++2SO42-+2Ba2++2OH-═Fe(OH)2↓+2BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 结论 | |
| A. | 向2 mL 0.1FeCl 3的溶液中加足量铁粉,震荡,加1滴KSCN溶液 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
| B. | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
| C. | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
| D. | 向2支盛有2 mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
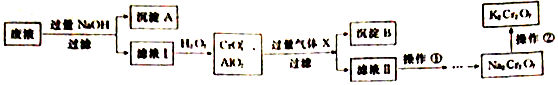
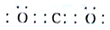 (填电子式)
(填电子式)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com