
【题目】硫酰氯(SO2Cl2) 和亚硫酰氯(SOCl2) 均是重要的化工试剂,遇水发生剧烈反应,常用作脱水剂。
已知:①SO2Cl2 (g)![]() SO2(g)+Cl2(g) △H= +471.7kJ/mol; 平衡常数K1
SO2(g)+Cl2(g) △H= +471.7kJ/mol; 平衡常数K1
②SO2(g) +Cl2(g) +SCl2(g)![]() 2SOCl2(g) △H=-477.3kJ/mol; 平衡常数 K2
2SOCl2(g) △H=-477.3kJ/mol; 平衡常数 K2
(1)反应2SOCl2(g)![]() SO2Cl2(g)+SCl2(g)的平衡常数K=_____(用K1、K2表示) 该反应△H=_____kJ/mol。
SO2Cl2(g)+SCl2(g)的平衡常数K=_____(用K1、K2表示) 该反应△H=_____kJ/mol。
(2)若在绝热、恒容的密闭容器中,投入一定量的SO2Cl2(g)和SCl2(g),发生反应SO2Cl2(g)+SCl2(g)![]() 2SOCl2(g),下列示意图能说明t1时刻反应达到平衡状态的是____(填序号)。
2SOCl2(g),下列示意图能说明t1时刻反应达到平衡状态的是____(填序号)。

(3)为研究不同条件对反应①的影响,在恒温条件下,向2L恒容密闭容器中加入0.2molSO2Cl2,10min后反应①达到平衡。测得10min内v(SO2)= 8.0×10-3mo1·L-1·min-1,则平衡时SO2Cl2的转化率α1=_______。若其它条件保持不变,反应①在恒压条件下进行,平衡时SO2Cl2的转化率α2_____α1(填“>”、“<”或“=”)。若要增大SO2Cl2的转化率,可以采取的措施有______(列举一种)。
(4)锂亚硫酰氯(Li/SOCl2) 电池是一种大容量电池,该电池用锂与石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4) 溶解在亚硫酰氣(SOCl2)中形成的,其电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S。
①写出电池工作时正极的电极反应式_____________;
②若用此电池做电源,以铂作电极电解200mL 0.2mol.L-1CuSO4溶液,当两极各产生标准状况下896mL的气体时,电池负极消耗锂的质量是______g。
【答案】 ![]() +5.6 bd 80% > 升高温度或增大容器体积或减小压强 3SOCl2+8e-==6Cl-+SO32-+2S 1.12
+5.6 bd 80% > 升高温度或增大容器体积或减小压强 3SOCl2+8e-==6Cl-+SO32-+2S 1.12
【解析】(1)由①+②可得,SO2Cl2(g)+SCl2(g)![]() 2SOCl2(g),则该反应的平衡常数K= K1
2SOCl2(g),则该反应的平衡常数K= K1![]() K2,△H=+471.7kJ/mol+(- 477.3kJ/mol)= -5.6 kJ/mol。因此,反应2SOCl2(g)
K2,△H=+471.7kJ/mol+(- 477.3kJ/mol)= -5.6 kJ/mol。因此,反应2SOCl2(g)![]() SO2Cl2(g)+SCl2的平衡常数K=
SO2Cl2(g)+SCl2的平衡常数K= ![]() ,该反应△H= +5.6 kJ/mol。
,该反应△H= +5.6 kJ/mol。
(2)若在绝热、恒容的密闭容器中,投入一定量的SO2Cl2(g)和SCl2(g),发生反应SO2Cl2(g)+SCl2(g)![]() 2SOCl2(g),该反应前后气体的分子数不变,但是由于该反应是放热反应,故在绝热、恒容条件下,容器内的压强会变大。正反应速率受温度和反应物浓度两个因素影响,t1时刻,图a中不能说明正反应速率和逆反应速率相等,故不能说明达到平衡;图b中t1时刻以后压强不变,说明达到平衡;c图中,各组分的浓度在t1时刻后仍在变化,所以t1时刻没有达到平衡;d图中,t1时刻以后反应物的转化率不再变化了,说明达到平衡。所以能说明t1时刻反应达到平衡状态的是b和d。
2SOCl2(g),该反应前后气体的分子数不变,但是由于该反应是放热反应,故在绝热、恒容条件下,容器内的压强会变大。正反应速率受温度和反应物浓度两个因素影响,t1时刻,图a中不能说明正反应速率和逆反应速率相等,故不能说明达到平衡;图b中t1时刻以后压强不变,说明达到平衡;c图中,各组分的浓度在t1时刻后仍在变化,所以t1时刻没有达到平衡;d图中,t1时刻以后反应物的转化率不再变化了,说明达到平衡。所以能说明t1时刻反应达到平衡状态的是b和d。
(3)反应①为SO2Cl2 (g)![]() SO2(g)+Cl2(g) △H=+471.7kJ/mol,该反应的正反应是一个气体分子数增大的吸热反应。在恒温条件下,向2L恒容密闭容器中加入0.2molSO2Cl2,10min后反应①达到平衡。测得10min内v(SO2)=8.0×10-3mo1.L-1.min-1,则平衡时SO2Cl2的变化量等于n(SO2)=10min
SO2(g)+Cl2(g) △H=+471.7kJ/mol,该反应的正反应是一个气体分子数增大的吸热反应。在恒温条件下,向2L恒容密闭容器中加入0.2molSO2Cl2,10min后反应①达到平衡。测得10min内v(SO2)=8.0×10-3mo1.L-1.min-1,则平衡时SO2Cl2的变化量等于n(SO2)=10min![]() 2L
2L![]() 8.0×10-3mo1.L-1.min-1=0.16mol,所以SO2Cl2的转化率α1=
8.0×10-3mo1.L-1.min-1=0.16mol,所以SO2Cl2的转化率α1=![]() 80%.若其它条件保持不变,反应①在恒压条件下进行,由于该反应正反应是气体分子数增大的方向,所以平衡时容器体积变大,相当于对恒容的平衡状态减压(即增大容器体积),故SO2Cl2的转化率变大,α2 >α1。若要增大SO2Cl2的转化率,可以采取的措施有升高温度或增大容器体积(即减小压强)。
80%.若其它条件保持不变,反应①在恒压条件下进行,由于该反应正反应是气体分子数增大的方向,所以平衡时容器体积变大,相当于对恒容的平衡状态减压(即增大容器体积),故SO2Cl2的转化率变大,α2 >α1。若要增大SO2Cl2的转化率,可以采取的措施有升高温度或增大容器体积(即减小压强)。
(4)由题意及电池总反应方程式8Li+3SOCl2=6LiCl+Li2SO3+2S可知,该电池负极为锂、正极为石墨。负极锂失去电子被氧化,电极反应式为8Li-8e- =8Li+,正极上SOCl2得到电子被还原为S。①电池工作时正极的电极反应式3SOCl2+8e-==6Cl-+SO32-+2S;②若用此电池做电源,以铂作电极电解200mL0.2mol.L-1CuSO4溶液,当两极各产生标准状况下896mL的气体时,因为阳极的电极反应产物只有氧气(阴极产物有铜和氢气),则阳极上产生896mL的氧气,这些氧气的物质的量为0.04mol,所以电路中一定通过了0.16mol e-。由电子转移守恒可知,电池负极消耗锂0.16mol,所以消耗锂的质量是016![]() 7g=1.12g。
7g=1.12g。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化: 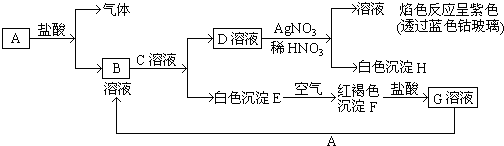
试回答:
(1)写出B的化学式D的化学式 .
(2)写出由E转变成F的化学方程式 .
(3)写出用KSCN鉴别G溶液的离子方程式;向G溶液加入A的有关离子反应方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y、Z、T 的原子序数依次增大,由这五种元素组成一种复盐(含2 种阳离子和1种阴离子的盐) M。M 中阳离子和阴离子总数相等。取少量M 溶于水,将所得溶液分成两份:一份滴加氯化钡溶液和盐酸,产生白色沉淀;另一份滴加氢氧化钠溶液,先产生白色沉淀,继续滴加则白色沉淀消失,反应过程中产生有刺激性气味的气体。下列说法正确的是
A. R、X 可以形成X2R4,电子式为![]()
B. 气态氢化物的稳定性: XH3>H2Y>H2T
C. Y 和Z形成的氧化物常作为除去A1Cl3溶液中少量的Fe3+的沉淀剂
D. M 的水溶液中离子浓度大小排序为:c(SO42-) >c(Al3+) > c(NH4+) > c(H+) > c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、CaMg(CO3)2、A12O3和Fe2O3等,回收其中镁的工艺流程如下:

沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
pH | 4.7 | 3.2 | 9.7 | 10.4 | 11.2 |
部分阳离子以氢氧化物形式完全深沉时溶液的pH 由见上表
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有_____________________(要求写出两条)
(2)滤渣I的主要成分有_________________________。
(3)从滤液II中可回收利用的主要物质有________________________。
(4)若最终得到的氯化镁溶液中,c(Mg2+)=0.02 mol·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5 mol·L-1 ,此时是否有Mg3(PO4)2沉淀生成?_______(列式计算)。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(5) Mg (C1O3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备: MgCl2+2NaC1O3=Mg (C1O3)2+2NaCl已知四种化合物的溶解度(S) 随温度(T) 变化曲线如下图所示: ①将反应物按化学反应方程式计量数比混合制备Mg (ClO3)2。简述可制备Mg (ClO3)2的原因:_______________________。
②按①中条件进行制备实验。在冷却降温析出Mg (ClO3)2过程中,常伴有NaCl 析出,原因是:__________。除去产品中该杂质的方法是:___________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W是中学常见的四种元素,原子序数依次增大。X的原子最外层电子数是次外层的2倍,Y 的氧化物属于两性氧化物,Y、Z 位于同周期,X、Y、Z的原子最外层电子数之和为14,W是人体必需的微量元素,缺乏W会导致贫血症状。
(1)X在元素周期表中的位置是_________________。
(2)下列事实能用元素周期律解释的是_____________________________________(填字母序号)。
A.Y 的最高价氧化物对应水化物的碱性弱于Mg(OH)2
B.Z的气态氢化物的稳定性小于HF
C.WZ3的溶液可用于刻蚀铜制的印刷电路板
(3)Z的单质可以从NaBr溶液中置换出Br2单质,从原子结构的角度解释其原因是______________________。
(4)工业上用电解法制备Y单质,化学方程式为___________________________。
(5)家用“管道通”的有效成分是烧碱和Y 的单质,使用时需加入一定量的水,此时发生反应的化学方程式为______________________________。
(6)W的单质可用于处理酸性废水中的NO3-,使其转化成为铵根离子,同时生成磁性的W的氧化物H,再进行后续处理。相应离子方程式为____________。Y 的单质与H在高温下反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
A. ①④ B. ②③
C. ①③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是燃烧和代谢的最终产物,也是造成温室效应的废气,但CO2作为一种资源,开发和利用的前景十分诱人。
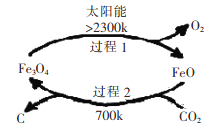
I、利用太阳能,以CO2为原料制取炭黑的流程如上图所示。过程2的化学方程式为:__________。
II、近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应制取甲醇。其工艺流程如图所示:

(1)①由吸收池导入分解池中的主要物质的化学式是____________。
②上述流程中____________(填化学式)可循环使用,该流程体现了“绿色化学”理念。
(2)不同温度下,在1L恒容密闭容器中充入2mol CO2和5 mol H2,相同时间内测得CO2的转化率随温度变化如下图所示:

①合成塔中发生的化学反应方程式为____________。
②T1时a点v(正)____________v(逆)(填“>”,“<”,“=”)
③计算温度为T4时b的平衡常数为____________。
(3)为检验吸收池中饱和K2CO3溶液是否充足,量取l00mL吸收液用0.10 mol./L盐酸滴定,生成的V(CO2)(标准状况下)随V(盐酸)变化关系如图所示:

则该l00mL吸收液还可吸收标准状况下_______mLCO2.
III、以稀硫酸为电解质溶液,惰性材料为电极,利用太阳能将CO2转化为低碳烯烃,工作原理如右图所示。

(1)H+的移动方向是_______________(填从左至右或从右至左);
(2)产生乙烯的电极反应式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com