
| A. | 离子半径:Na+>Mg2+>Al3+>F- | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3 | D. | 酸性强弱:H2SO4>H2CO3>H2SiO3 |
分析 A.具有相同电子排布的离子,原子序数大的离子半径小;
B.非金属性越强,对应氢化物越稳定;
C.金属性越强,对应最高价氧化物的水化物碱性越强;
D.非金属性越强,对应最高价氧化物的水化物酸性越强.
解答 解:A.具有相同电子排布的离子,原子序数大的离子半径小,则离子半径:F->Na+>Mg2+>Al3+,故A错误;
B.非金属性Cl>S>P,热稳定性:HCl>H2S>PH3,故B正确;
C.金属性K>Na>Mg>Al,对应最高价氧化物的水化物碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3,故C正确;
D.非金属性S>C>Si,对应最高价氧化物的水化物酸性为H2SO4>H2CO3>H2SiO3,故D正确;
故选A.
点评 本题考查周期表及元素周期律的综合应用,为高频考点,把握元素的位置、性质及元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
| W | X | |
| Y | Z |
| A. | 离子半径:Z>Y>X>W | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y | |
| C. | X、Y、Z的气态氢化物中,Z的熔点最高 | |
| D. | X元素的一种氢化物含极性键和非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用干燥洁净的玻璃棒蘸取NaClO溶液,滴到表面皿上的pH试纸上测pH | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上2%~5%的硼酸溶液 | |
| C. | 取金属钠时,要先用镊子夹取,再用小刀切下所需量,剩余钠不能放回原试剂瓶中 | |
| D. | 用NaOH标准溶液滴定盐酸,滴定管尖嘴部分若在滴定前无气泡,滴定终点时出现气泡,测定结果将偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ②
② ③(CH3)3CCH2Cl ④CHCl-CHBr2⑤
③(CH3)3CCH2Cl ④CHCl-CHBr2⑤ ⑥CH3Cl.
⑥CH3Cl.| A. | ②③⑤ | B. | ①③⑥ | C. | 全部 | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
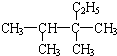 2,3,3=三甲基戊烷 (6)
2,3,3=三甲基戊烷 (6)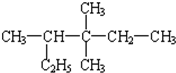 3,3,4-三甲基己烷.
3,3,4-三甲基己烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁、铝在常温下都能被浓硫酸“钝化” | |
| B. | 足量铝分别与含1molHCl、1molNaOH的溶液反应,产生相同量的氢气 | |
| C. | 燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| D. | 浓硫酸与铜反应既体现了其强氧化性又体现了其酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
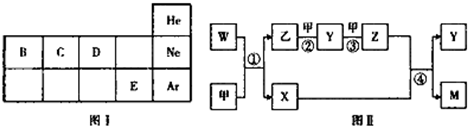
 ,Y的分子式为NO,W的结构式为
,Y的分子式为NO,W的结构式为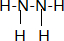 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com