
 某同学对实验室用石灰石和稀盐酸制取二氧化碳后的溶液进行成分鉴定,取废液的上层清液,开始出现气泡,滴加至10g才开始出现白色沉淀,继续滴加至沉淀不再产生,过滤,测的沉淀的质量为5g,并绘制出下列图象.
某同学对实验室用石灰石和稀盐酸制取二氧化碳后的溶液进行成分鉴定,取废液的上层清液,开始出现气泡,滴加至10g才开始出现白色沉淀,继续滴加至沉淀不再产生,过滤,测的沉淀的质量为5g,并绘制出下列图象.| m |
| ρ |
| 1000×1.25g/ml×26.5% |
| 106g/mol |
| 1mol |
| 0.025mol |
| 22.4L |
| V |
| 106g |
| m |
| 100g |
| 5g |
| 5.3g |
| 26.5% |
| m |
| ρ |
| 30g |
| 1.25g?mL-1 |


科目:高中化学 来源: 题型:
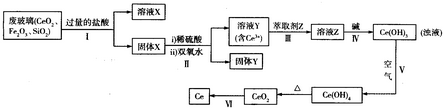
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol |
| B、0.2 mol |
| C、0.05 mol |
| D、0.025 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、海水中含有镁元素,只需经过物理变化就可以得到镁单质 |
| B、海水蒸发制海盐的过程中只发生了化学变化 |
| C、从海水中可以得到NaCl,电解NaCl溶液可得到金属钠 |
| D、从海水中提取Br2、I2的过程中发生了氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
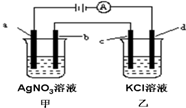 如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )| A、乙烧杯中的d电极反应式为Fe-2e-=Fe2+ |
| B、当电解一段时间后,将甲、乙两溶液混合,一定会沉淀 |
| C、当b极增重5.4g时,d极产生的气体为2.24L(标准状况) |
| D、甲烧杯中溶液的pH降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该元素位于第五周期IB族 |
| B、该元素原子核外有5个电子层 |
| C、该元素原子最外层共有2个电子 |
| D、该元素原子M层上共有18个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com