
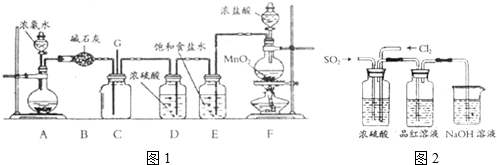
分析 (1)二氧化锰与浓盐酸反应生成氯气、氯化锰和水,依据反应中氯化氢中元素化合价变化判断盐酸表现的性质;
(2)浓盐酸易挥发,该实验中制得的氯气中含有氯化氢杂质,应除去;
(3)由题意可知发生反应为氨气和氯气生成氯化铵和氮气,依据原子个数、得失电子守恒写成反应方程式;
(4)①氯气和二氧化硫在水溶液中恰好发生氧化还原反应,转化成没有漂白性的盐酸和硫酸,所以品红溶液几乎不褪色;
②当通入的二氧化硫或者氯气一方有剩余时,又会使品红溶液褪色.
解答 解:(1)装置F中二氧化锰与浓盐酸加热生成氯气,方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应中有4mol氯化氢参加反应,只有2mol氯离子中的氯化合价升高,所以浓盐酸在反应中既表现还原性,又表现酸性,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;酸性;还原性;
(2)浓盐酸易挥发,该实验中制得的氯气中含有氯化氢杂质,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以可以用E除去,
故答案为:吸收氯气中的氯化氢;
(3)氨气和氯气反应生成白烟氯化铵和空气的主要成分之一氮气,反应的化学方程式为:8NH3+3Cl2═6NH4Cl+N2,
故答案为:8NH3+3Cl2═6NH4Cl+N2;
(4)①氯气具有强氧化性,二氧化硫具有还原性,在水溶液二者发生氧化还原反应生成硫酸和盐酸,硫酸和盐酸都没有漂白性,所以如果控制SO2和Cl2按物质的量之比1:1进气,则溶液不褪色,发生的离子反应方程式为:SO2+Cl2+H2O=4H++SO42-+2Cl-,
故答案为:控制SO2和Cl2按物质的量之比1:1进气;SO2+Cl2+H2O=4H++SO42-+2Cl-;
②次氯酸和二氧化硫都能使品红溶液褪色,如果氯气或二氧化硫过量,则溶液会慢慢褪色,所以要使品红溶液褪色,则应该控制SO2和Cl2进气的物质的量,使之不相等,
故答案为:控制SO2和Cl2进气的物质的量,使之不相等.
点评 本题考查了二氧化硫、氯气的实验室制法、性质等知识点,明确实验原理是解本题关键,再结合物质间的反应来分析解答,注意次氯酸和二氧化硫都具有漂白性,但氯气和二氧化硫的混合物可能没有漂白性,知道二氧化硫和次氯酸漂白原理的差别,二氧化硫不能使酸碱指示剂褪色,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | DNOP(邻苯二甲酸二辛脂)是一种由邻苯二甲酸和正辛醇经脂化反应而得的一种酯类有机化合物,常用作增塑剂、溶剂以及气相色谱固定液,对人体无害,可用作食品添加剂 | |
| B. | 铝及其合金是电气、工业、家底广泛使用的材料,是因为铝的冶炼方法比较简单 | |
| C. | 陶瓷、砖瓦、玻璃、水泥都是硅酸盐产品 | |
| D. | 白酒标签上注有“酒精度52%Vol”字样,它表示100g该白酒中含有52g洒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1NH4NO3溶液中:c(NH4+)>c(NO3-)>c(H+)>c(OH-) | |
| B. | 溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(CO32-)+c(HCO3-)+c( H2CO3) | |
| C. | 向10mL0.2mol•L-1NaCl溶液中滴入2mL0.1mol•L-1AgNO3溶液,溶液中离子浓度大小关系:c(Na+)>c(NO3-)=c(Cl-)>c(Ag+) | |
| D. | 常温下pH=2的醋酸与pH=12的烧碱溶液等体积混合:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
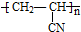 )混合物制作而成的复合材料.工业上用氧化铝电解冶铝的化学方程式为2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;聚丙烯腈单体分子中位于同一平面的原子数目最多为7个.
)混合物制作而成的复合材料.工业上用氧化铝电解冶铝的化学方程式为2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;聚丙烯腈单体分子中位于同一平面的原子数目最多为7个.
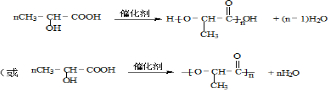 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向逆反应方向移动了 | B. | 物质A的转化率增大 | ||
| C. | 物质C的质量分数增大 | D. | m>2n |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com