
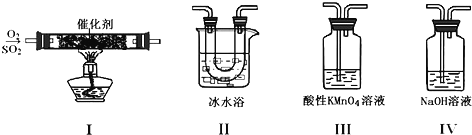
【题目】利用如图所示的装置研究SO2的性质:
已知:
物质 | 熔点℃ | 沸点℃ |
SO2 | -76.1 | -10 |
SO3 | 16.8 | 45 |
(1)装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式________________。
(2)甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是___;观察到装置Ⅲ中现象是________________,说明二氧化硫具有___性
(3)乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置(装置Ⅱ中充分冷却),若装置Ⅳ中有40mL2.5mol/LNaOH溶液,反应后增重4.8g,则装置Ⅳ中发生反应的总的化学方程式是___
【答案】2SO2+O2![]() 2SO3 使SO3凝结成固体与SO2分离 溶液颜色褪去(或变浅) 还原 4NaOH+3SO2=Na2SO3+2NaHSO3+H2O
2SO3 使SO3凝结成固体与SO2分离 溶液颜色褪去(或变浅) 还原 4NaOH+3SO2=Na2SO3+2NaHSO3+H2O
【解析】
装置Ⅰ中,发生反应2SO2+O2![]() 2SO3,由于反应可逆,生成的SO3中混有SO2和O2;装置Ⅱ中,冰水浴使混合气中的SO3凝结成固体;装置Ⅲ中,SO2被酸性KMnO4溶液吸收,从而使酸性KMnO4溶液褪色;装置Ⅳ用于吸收尾气,将SO2转化为Na2SO3或NaHSO3或二者的混合物。
2SO3,由于反应可逆,生成的SO3中混有SO2和O2;装置Ⅱ中,冰水浴使混合气中的SO3凝结成固体;装置Ⅲ中,SO2被酸性KMnO4溶液吸收,从而使酸性KMnO4溶液褪色;装置Ⅳ用于吸收尾气,将SO2转化为Na2SO3或NaHSO3或二者的混合物。
(1)由以上分析可知,装置 Ⅰ 模拟工业生产中SO2催化氧化的反应,其化学方程式为2SO2+O2![]() 2SO3。答案为:2SO2+O2
2SO3。答案为:2SO2+O2![]() 2SO3;
2SO3;
(2)由以上分析知,装置Ⅱ的作用是使SO3凝结成固体与SO2分离;装置Ⅲ中发生反应:5SO2+2KMnO4+2H2O==K2SO4+2MnSO4+2H2SO4,观察到现象是溶液颜色褪去(或变浅),说明二氧化硫具有还原性。答案为:使SO3凝结成固体与SO2分离;溶液颜色褪去(或变浅);还原;
(3)n(NaOH)=0.040L×2.5mol/L=0.1mol,n(SO2)=![]() =0.075mol,n(NaOH):n(SO2)== 0.1mol:0.075mol=4:3,则装置Ⅳ中发生反应的总的化学方程式是4NaOH+3SO2==Na2SO3+2NaHSO3+H2O。答案为:4NaOH+3SO2==Na2SO3+2NaHSO3+H2O。
=0.075mol,n(NaOH):n(SO2)== 0.1mol:0.075mol=4:3,则装置Ⅳ中发生反应的总的化学方程式是4NaOH+3SO2==Na2SO3+2NaHSO3+H2O。答案为:4NaOH+3SO2==Na2SO3+2NaHSO3+H2O。


科目:高中化学 来源: 题型:
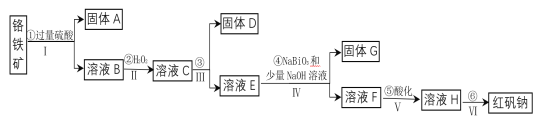
【题目】工业上以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为:Na2Cr2O7·2H2O),其主要工艺流程如下:
查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42—,自身被还原为Bi(OH)3固体。
ii.
物质 | Fe(OH)3 | Al(OH)3 | Cr(OH)3 | Fe(OH)2 | Bi(OH)3 |
开始沉淀的PH | 2.7 | 3.4 | 4.6 | 7.5 | 0.7 |
完全沉淀的PH | 3.7 | 4.4 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)将铬铁矿矿石粉碎的目的是___________。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和___________(填仪器名称)。
(3)写出④反应的化学方程式________________。
(4)⑤中酸化是使CrO42—转化为Cr2O72—。写出该反应的离子方程式______。
(5)将溶液H经下列操作:蒸发浓缩,__________,过滤,洗涤,干燥即得红矾钠。
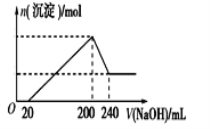
(6)取一定质量的固体D溶解于200mL的稀硫酸中,向所得溶液中加入5.0mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为_________,固体D中含Fe化合物的物质的量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】西安北郊古墓中曾出土一青铜锤(一种酒具),表面附着有绿色固体物质,打开盖子酒香扑鼻,内盛有26 kg青绿色液体,专家认定是2000多年前的“西汉美酒”。这是我国考古界、酿酒界的一个重大发现。
(1)上述报道引发了某校化学兴趣小组同学的关注,他们收集家中铜器表面的绿色固体进行探究。
提出问题:铜器表面附着绿色固体物质是由哪些元素组成的?
猜想:查阅相关资料后,猜想绿色固体物质可能是铜绿。
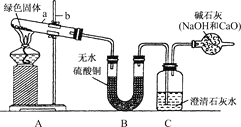
实验步骤:
①对试管内的绿色固体进行加热,至完全分解.观察到A装置中绿色固体逐渐变成黑色,B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊.
②取少量加热后生成的黑色固体于试管中,加入稀硫酸.观察到黑色固体逐渐溶解,溶液变成蓝色。
③取少量上述蓝色溶液于试管中,浸入一根洁净的铁丝.观察到铁丝表面有红色物质析出。
④实验结论:绿色固体物质中含有________、________、________、________等元素。(提示:装置内的空气因素忽略不计)
(2)表达与交流:①图中标有a、b的仪器名称是:a:________;b:________。
②上述实验步骤③中发生反应的离子方程式为____________________________。
③反应完成后,如果先移去酒精灯,可能出现的现象是______________________。
④如果将B、C两装置对调行吗?____。为什么?______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】祖母绿的主要成分为Be3Al2Si6Ol8,含有O、Si、Al、Be等元素。请回答下列问题:
(1)基态A1原子中,电子占据的最高能级的符号是_______________________,该能级具有的原子轨道数为_______。
(2)在1000℃时,氯化铍以BeCl2形式存在,其中Be原子的杂化方式为_________;在500600℃气相中,氯化铍则以二聚体Be2Cl4的形式存在,画出Be2Cl4的结构____________,1molBe2Cl4中含有____mol配位键。
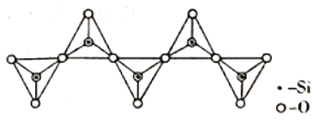
(3)氢化铝锂(LiAlH4)是有机合成中一种重要的还原剂,LiAlH4的阴离子的空间构型为____________,该阴离子的等电子体为____________(写一种分子、一种离子)。一种无限长单链结构的多硅酸根的一部分如图所示,则该硅酸根的化学式为____________________。
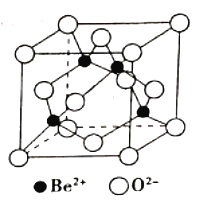
(4)用氧化物的形式表示出祖母绿的组成:___________。如图是Be与O形成的氧化物的立方晶胞结构,已知氧化铍的密度为ρg/cm3,则晶胞边长为__________cm。(设NA为阿伏加德罗常数的值,用含ρ、NA的代数式表示),O2-的配位数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是

A. 转移0.1mol电子时,a电极产生标准状况下O2 1.12L
B. b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH-
C. c电极上进行还原反应,B池中的H+可以通过隔膜进入A池
D. d电极上发生的电极反应是:O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种晶体的晶胞如图所示:
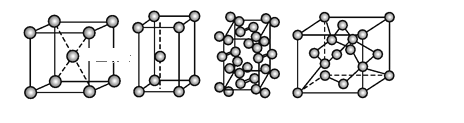
所示晶胞从左到右分别表示的物质正确的排序是
A. 碘、锌、钠、金刚石B. 金刚石、锌、碘、钠
C. 钠、锌、碘、金刚石D. 锌、钠、碘、金刚石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界中。回答下列问题:
(1)在基态14C原子中,核外存在______对自旋相反的电子。
(2)碳在形成化合物时,其键型以共价键为主,原因是__________。
(3)CS2分子中,共价键的类型有________,C原子的杂化轨道类型是______,写出两个与CS2具有相同空间构型和键合形式的分子或离子_______。
(4)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
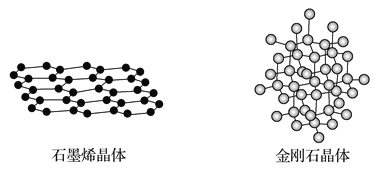
①在石墨烯晶体中,每个C原子连接_____个六元环,每个六元环占有___个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接_____个六元环,六元环中最多有______个C原子在同一平面。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种有机玻璃的结构简式为 。下列关于它的叙述中不正确的是( )
。下列关于它的叙述中不正确的是( )
A. ![]() 在一定条件下发生缩聚反应即可合成该有机玻璃
在一定条件下发生缩聚反应即可合成该有机玻璃
B. 该有机玻璃能发生氧化反应
C. 合成该有机玻璃的原料可能有甲烷
D. 它在一定条件下发生水解反应时C—O键断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是一种剧毒气体,对H2S废气资源化利用的途径之一是回收能量并得到单质硫。如图为质子膜H2S燃料电池的示意图。下列说法正确的是( )
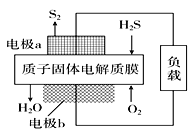
A. 电极a发生还原反应
B. 当电路中通过4 mol电子时,有4molH+经质子膜进入负极区
C. 电池总反应为:2H2S+3O2 =2SO2+2H2O
D. 电极b的电极反应式为:O2+4e-+4H+=2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com