
| 实验操作步骤 | 预期现象与结论 |
| 步骤1:观察样品 | 溶液呈蓝绿色,①不能(填“能”或“不能”)确定产物中铁元素的价态 |
| 步骤2: 取少量溶液,滴加酸性KMnO4溶液 | ②若KMnO4溶液的紫红色褪去或变浅,说明产物中含+2价铁元素,若KMnO4溶液不褪色或红色不变浅,说明产物中不含+2价铁元素 |
| 步骤3:③另取少量溶液,滴加KSCN溶液 | 若溶液变为红色,说明产物中含+3价的铁元素;若溶液颜色无明显变化,则说明产物中不含+3价的铁元素 |
分析 I、(1)直接用铜屑与稀硝酸反应来制取硝酸铜,发生3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(2)灼烧在坩埚中进行,从反应后的溶液中得到硝酸铜晶体,晶体含结晶水,需要蒸发浓缩、冷却结晶;
Ⅱ、加入Cu(NO3)2溶液,滴入适量稀硫酸酸化,再加入一定量铁粉,酸性条件下Fe与硝酸根离子发生氧化还原反应,生成可能生成硝酸铁或硝酸亚铁或二者的混合物,亚铁离子具有还原性,铁离子遇KSCN溶液为血红色,以此来解答.
解答 解:I、(1)直接用铜屑与稀硝酸反应来制取硝酸铜,发生3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,硝酸作酸和氧化剂,且生成有毒气体NO,则两个不利因素是生成等物质的量硝酸铜时消耗的硝酸多、产生污染物NO,
故答案为:生成等物质的量硝酸铜时消耗的硝酸多;产生污染物NO;
(2)实验中铜粉应该放在坩埚中灼烧.欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤按顺序分别是蒸发浓缩、冷却结晶、过滤,
故答案为:坩埚;蒸发浓缩;冷却结晶;
Ⅱ、(3)加入Cu(NO3)2溶液,滴入适量稀硫酸酸化,再加入一定量铁粉,酸性条件下Fe与硝酸根离子发生氧化还原反应,生成可能生成硝酸铁或硝酸亚铁或二者的混合物,
则观察样品,溶液呈蓝绿色,不能确定产物中铁元素的价态;取少量溶液,滴加酸性KMnO4溶液,若KMnO4溶液的紫红色褪去或变浅,说明产物中含+2价铁元素,若KMnO4溶液不褪色或红色不变浅,说明产物中不含+2价铁元素;另取少量溶液,滴加KSCN溶液,若溶液变为红色,说明产物中含+3价的铁元素;若溶液颜色无明显变化,则说明产物中不含+3价的铁元素,
故答案为:①不能;②若KMnO4溶液的紫红色褪去或变浅,说明产物中含+2价铁元素,若KMnO4溶液不褪色或红色不变浅,说明产物中不含+2价铁元素;③另取少量溶液,滴加KSCN溶液.
点评 本题考查性质实验方案的设计,为高频考点,把握物质的性质、发生的反应、离子的检验和性质为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:解答题
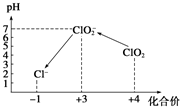 Cl2、ClO2等气体可作为水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.
Cl2、ClO2等气体可作为水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
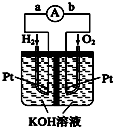 在能源日趋紧张的今天,科学工作者一直在研究如何提高现有化石能源的利用率,同时寻找开发清洁可再生能源.常采用的方法有煤的气化、煤的液化、设计燃料电池等.
在能源日趋紧张的今天,科学工作者一直在研究如何提高现有化石能源的利用率,同时寻找开发清洁可再生能源.常采用的方法有煤的气化、煤的液化、设计燃料电池等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+与SO42-的物质的量浓度之比为2:3 | |
| B. | 1L溶液中SO42-的物质的量为1.5mol | |
| C. | 准确称取17.1g的Al2(SO4)3用100 mL蒸馏水溶解可配制得到该浓度的溶液 | |
| D. | 从1L 0.5 mol•L-1Al2(SO4)3溶液中取出100mL,Al3+浓度仍为1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钛(Ti)被称为继铁、铝之后的第三金属.
钛(Ti)被称为继铁、铝之后的第三金属.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
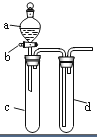 某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.
某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.| 方案 | 反应物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、O2、稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,锌失去电子,电解液内部OH-向负极移动 | |
| B. | 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq) | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MOH能被醋酸中和 | |
| B. | 用MOH溶液做导电性实验,灯泡亮度较暗 | |
| C. | MOH可使酚酞试液变红 | |
| D. | 常温时0.1mol•L-1MOH溶液的pH约为11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com