
| A. | 标准状况下,3.36 L氟化氢中含有的电子数目为1.5NA | |
| B. | 常温常压下,7.0 g乙烯与丙烯的混合物中含有共用电子对的数目为1.5NA | |
| C. | 标准状况下,22.4 L己烷中含共价键数目为19 NA | |
| D. | 18 g D2O和18 g H2O中含有的质子数均为10NA |
分析 A.标况下氢氟酸为液体;
B.1个乙烯分子含有4个C-H、1个C=C,共用电子对为6对,1个丙烯分子中含有6个C-H、1个C-C、1个C=C,共用电子对为:9对,乙烯和丙烯最简式都是CH2,相当于每个CH2共用3对电子;
C.标况下己烷为液体;
D.质量转化为物质的量,结合1个D2O和1个H2O中都含有10个质子;
解答 解:A.标况下,氢氟酸为液体不能使用气体摩尔体积,故A错误;
B.乙烯和丙烯最简式都是CH2,70g乙烯和丙烯混合物含有CH2单元0.5mol,含有共用电子对0.5mol×3=1.5mol,含有共用电子对的数目为1.5NA,故B正确;
C.标准状况下己烷为液体,不能使用气体摩尔体积,无法计算22.4 L己烷物质的量,故C错误;
D.18 g D2O物质的量为$\frac{18g}{20g/mol}$=0.9mol,含有9NA个质子,18 g H2O物质的量为$\frac{18g}{18g/mol}$=1mol,含有的质子数为10NA,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常的应用,主要考查气体摩尔体积的体积应用,质量换算物质的量计算微粒数,注意标况下HF和己烷为液体,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:解答题
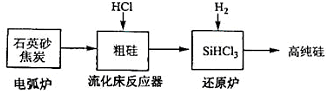
| 发生的主要反应 | |
| 电弧炉 | SiO2+2C$\stackrel{1600-1800℃}{?}$Si+2CO↑ |
| 流化床反器 | Si+3HCl$\stackrel{250-300℃}{?}$SiHCl3+H2 |
| 还原炉 | SiHCl3+H2$\stackrel{1100-1200℃}{?}$Si+3HCl |
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.
某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯(乙炔):酸性高锰酸钾溶液 | |
| B. | 溴苯(苯):液溴、铁粉 | |
| C. | 乙烷(乙烯):氢气、镍 | |
| D. | 苯(甲苯):酸性高锰酸钾溶液、氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
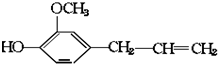 其可能具有的性质是( )
其可能具有的性质是( )| A. | ②③ | B. | ①②③④ | C. | ①②③④⑤ | D. | ①②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解法 | B. | 热还原法 | C. | 热分解法 | D. | 铝热法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO+H2O═Ca(OH)2 | B. | CO2+C $\frac{\underline{\;高温\;}}{\;}$ 2CO | ||
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | D. | NaOH+HCl═NaCl+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
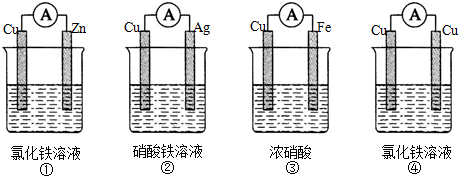
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com