
| A. | 放电时,NaTi2(PO4)3发生氧化反应 | |
| B. | 放电时,Na+向锌棒一极移动 | |
| C. | 充电时,阳极反应式为[Ti2(PO4)3]+-2e-=[Ti2(PO4)3]3+ | |
| D. | 充电时,每转移0.2 mol电子,阴极增重6.5 g |
分析 由反应总方程式可知,形成原电池时Zn元素化合价升高,被氧化,应为原电池负极反应,Ti元素化合价由+4价降低为+3价,为原电池正极反应,结合电极方程式解答该题.
解答 解:A.放电时,Ti元素化合价由+4价降低为+3价,则NaTi2(PO4)3发生还原反应,故A错误;
B.放电时,阳离子向正极移动,而锌为负极,故B错误;
C.充电时,阳极反应应为[Ti2(PO4)3]3--2e-=[Ti2(PO4)3]-,故C错误;
D.阴极发生Zn-2e-=Zn2+,充电时,每转移0.2 mol电子,生成0.1molZn,则增重6.5 g,故D正确.
故选D.
点评 本题考查化学电源新型电池,为高频考点,侧重考查学生的分析能力,明确元素化合价变化与电极名称关系是解本题关键,难点是电极反应式的书写,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
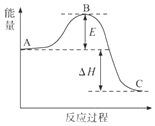 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 水 | Na2CO3 | 混合前温度 | 混合后温度 |
| 35mL | 3.2g | 20℃ | 24.3℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的实验式:H2C═CH2 | B. | 四氯化碳的电子式: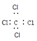 | ||
| C. | 含10个中子的氧原子:${\;}_{8}^{18}$O | D. | Al3+的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因铝表面能形成致密的氧化膜,所以铝制餐具可以长期使用 | |
| B. | 纤维的应用很广,人造纤维、合成纤维和光导纤维都是有机高分子化合物 | |
| C. | 新买的衣服先用水清洗,可除去衣服上残留的有防皱作用的甲醛整理剂 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 组别 | 实验温度 (℃) | H2O2溶液 | FeCl3溶液 (1mol/L) |
| 1 | 30 | 5mL 4% | 1mL |
| 2 | 60 | 5mL 4% | 1mL |
| 3 | 30 | 5mL 12% | |
| 4 | 30 | 5mL 4% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
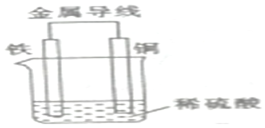 现有反应:①Ba(OH)2•8H2O+2NH4Cl═2NH3↑+BaCl2+10H2O,②Fe+H2SO4═FeSO4+H2↑.试回答下列问题:
现有反应:①Ba(OH)2•8H2O+2NH4Cl═2NH3↑+BaCl2+10H2O,②Fe+H2SO4═FeSO4+H2↑.试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com