
| A�� | ���ع��͡������Ƴɷ����������Դ�������� | |
| B�� | ʳƷ�д������ӱ������Ƶȷ�����������Ч�ӳ��䱣���� | |
| C�� | �ӿ쿪����Ч�ྻ��Դת��������������ԴΣ�� | |
| D�� | ��APEC������2014���µ�����ʻ㣬����2014��APEC�����ڼ䱱����������գ�˵������ʵʩ��·���к���Ⱦ��ҵͣ���ȴ�ʩ���Լ�����������֤������������Ч�� |
���� A�������ع��͡��Ƴɷ��������Ա��Ϊ����
B������ʳƷ������Ӧ���涨��������ʹ�òŰ�ȫ��
C����Ч�ྻ��Դ�Ƕ���̬��������Ⱦ������Ⱦ����Դ��
D����·���пɼ�������β���ŷţ���Ⱦ��ҵͣ���ɼ�����Ⱦ��
��� �⣺A�����ع��͡�����һ������������������ķ�ʳ���ͣ������Ƴɷ�����ʵ����ʹ������֬��������Ӧ������ʳ���ͱ�ɷ��������������Դ�������ʣ���A����
B������ʳƷ��������Ŀ����Ϊ�˸���ʳƷƷ�ʡ��ӳ������ڡ�����ӹ��ͱ�ȫӪ���ɷ֣����涨��������ʹ�ò��ǰ�ȫ�ģ��������ӣ���ı�ʳƷ�Ľṹ����ɣ�ʹʳƷ��IJ���ȫ�����������Σ��������°����������ӱ������ƣ���ı�ʳƷ�Ŀ�ζ��Ӫ���ɷ֣���B��ȷ��
C�������Դ������ָ�ڿ�������Դ������Դ��ú������Ч���õ������Ķ���̬��������Ⱦ������Ⱦ���¼������ӿ��Ч�ྻ��Դת�������Ŀ������ܻ�����ԴΣ������C��ȷ��
D����·���пɼ�������β���ŷţ���Ⱦ��ҵͣ���ɼ�����Ⱦ���ɼ�����������֤������������D��ȷ��
��ѡA��
���� ���⿼���˳���ʳƷ���Ӽ����ع��͵������г��������ʵ����ʣ�������ص�֪ʶ���н����Ŀ�ϼ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
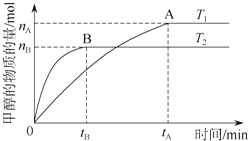 ��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ/mol��-283.0kJ/mol��-726.5kJ/mol����ش��������⣺
��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ/mol��-283.0kJ/mol��-726.5kJ/mol����ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
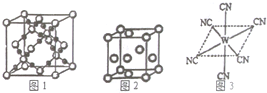 ��֪A��B��C��D��E��W����Ԫ�ص�ԭ���������ε�������λ��ǰ�����ڣ�����A��Dԭ�ӵ�������������������������������Dԭ�ӵĵ��Ӳ�����A��3����Bԭ�Ӻ��������6�ֲ�ͬ���˶�״̬����s�����������p�����������������Cԭ��L������2�ԳɶԵ��ӣ�E�С����������֮�ƣ�E4+���Ӻ��ԭ�ӵĺ�������Ų���ͬ��Wλ�����ڱ��е�8�У���ش�
��֪A��B��C��D��E��W����Ԫ�ص�ԭ���������ε�������λ��ǰ�����ڣ�����A��Dԭ�ӵ�������������������������������Dԭ�ӵĵ��Ӳ�����A��3����Bԭ�Ӻ��������6�ֲ�ͬ���˶�״̬����s�����������p�����������������Cԭ��L������2�ԳɶԵ��ӣ�E�С����������֮�ƣ�E4+���Ӻ��ԭ�ӵĺ�������Ų���ͬ��Wλ�����ڱ��е�8�У���ش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ��װ�� | ʵ��Ŀ�� |
| A | 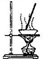 | ��������ͭ��������ˮ����ͭ |
| B | 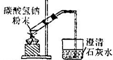 | ����̼�����ƣ�֤�����ֽܷ��ͷų�������̼���� |
| C | 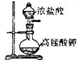 | ʵ������ȡ���� |
| D | 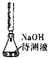 | ���к͵ζ��ķ����ⶨij�������ƴ���Һ��Ũ�� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��֪ | ���� | |
| A | �����Ǵ���ɵ����� | ����ɵ�����һ�������� |
| B | ϡ�������������Һʱ������ȼ�ϵ�صĸ�����ӦΪ 2H2-4e-=4H+ | ����������Һ���������Һʱ������ȼ�ϵ�صĸ�����ӦΪ2H2-3e-+4OH-=4H2O |
| C | ��Fe���뵽CuSO4��Һ�� Fe+Cu2+=Cu+Fe2+ | ��Na���뵽CuSO4��Һ�� 2Na+Cu2+=Cu+2Na+ |
| D | ԭ�����ͨ���ǻ��ý����������������ý��������� | ͭ������Ũ���ṹ��ԭ���ʱ��ͭ������ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Fe��NO3��2��KI�����Һ�м�������ϡ���3Fe2++4H++NO3-�T3Fe3++2H2O+NO�� | |
| B�� | ����������Һ�м��������İ�ˮ��Ag++2NH3•H2O�TAg��NH3��2++2H2O | |
| C�� | ��ĭ����������ԭ����2Al3++3CO32-+3H20�T2Al��OH��3��+3CO2�� | |
| D�� | �������İ�ˮ�������Ṥҵ��β����SO2+NH3•H2O�TNH4++HSO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Al14��42���۵��ӣ�����IIA��Ԫ���������� | |
| B�� | Al13��39���۵��ӣ�����±���������� | |
| C�� | Al13����������HI��Ӧ������HAl13I���һ�ѧ����ʽΪ Al13+HI=HAl13I | |
| D�� | Al13ԭ����A1ԭ�Ӽ���ͨ�����Ӽ���ϵ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
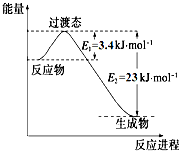 �о������ḻ��CO2��ȫ������Ϊ��̼Դ�������ǰӦ����㷺��̼Դ��ʯ�ͺ���Ȼ��������������Ҷ���ݽߵ�Σ����ͬʱ�ֿɻ�����CO2�ۻ�������������ЧӦ��ʵ��CO2������ѭ����
�о������ḻ��CO2��ȫ������Ϊ��̼Դ�������ǰӦ����㷺��̼Դ��ʯ�ͺ���Ȼ��������������Ҷ���ݽߵ�Σ����ͬʱ�ֿɻ�����CO2�ۻ�������������ЧӦ��ʵ��CO2������ѭ����| ʵ����[ | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �±��г��˶���ijЩ��ѧ�������������
�±��г��˶���ijЩ��ѧ�������������| ��ѧ�� | H-H | Cl-Cl | I-I | O�TO | C-Cl | C-H | O-H | H-Cl | H-I |
| ����1mol��ѧ�������յ�������kJ�� | 436 | 247 | 151 | x | 330 | 413 | 463 | 431 | 299 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com