
根据要求回答下列问题。
(1)相同质量的SO2气体和SO3气体,其分子数之比为__________,氧原子数之比为__________,相同条件下(同温同压)的体积之比为__________,密度之比为__________。
(2)SO2与O2的混合气体中,氧元素的质量分数为70%,则SO2与O 2的物质的量之比是__________,这种混合气体的密度是同温同压下氧气密度的_______
2的物质的量之比是__________,这种混合气体的密度是同温同压下氧气密度的_______ __倍。
__倍。
(3)用2.4 mol·L-1的H2SO4溶液配制100 mL浓度为0.2 mol·L-1的稀硫酸,需量取2.4 mol·L-1的H2SO4溶液的体积是__________mL。
(4)试分析下列操作对所配溶液的浓度有何影响(填“偏高”“偏低”或“无影响”)。
①未洗涤烧杯和玻璃棒,使所配溶液浓度________;
②定容时俯视刻度线,使所配溶液浓度________;
③摇匀后,发现液面低于刻度线,又滴加蒸馏水,使所配溶液浓度________。
 【解析】(1)设SO2与SO3均为1 g,则n(SO2)=
【解析】(1)设SO2与SO3均为1 g,则n(SO2)=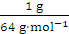 =
=
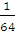 mol,n(SO3)=
mol,n(SO3)=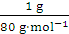
=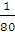 mol,则SO2中n(O)=2n(SO2)=
mol,则SO2中n(O)=2n(SO2)=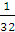 mol,SO3中n(O)=
mol,SO3中n(O)=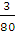 mol,故分子数之比为
mol,故分子数之比为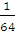 ∶
∶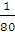 =5∶4,氧原子数之比为
=5∶4,氧原子数之比为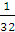 ∶
∶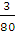 =5∶6。据阿伏加德罗定律:体积之比等于物质的量之比,即V(SO2)∶V(SO3)=5∶4,密度之比等于摩尔质量之比,即ρ(SO2)∶
=5∶6。据阿伏加德罗定律:体积之比等于物质的量之比,即V(SO2)∶V(SO3)=5∶4,密度之比等于摩尔质量之比,即ρ(SO2)∶
ρ(SO3)=64∶80=4∶5。
(2)设有100 g混合物,则氧元素的质量为70 g,硫元素的质量为30 g,二氧化硫中硫元素的质量分数为50%,则二氧化硫的质量为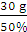 =60 g,氧气的质量为100 g-
=60 g,氧气的质量为100 g-
60 g=40 g,氧气的摩尔质量是32 g·mol-1,二氧化硫的摩尔质量是64 g·mol-1,SO2与O2的物质的量之比为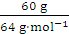 ∶
∶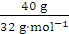 =3∶4,同温同压下气体的密度比等于摩尔质量比,混合气体的平均摩尔质量为
=3∶4,同温同压下气体的密度比等于摩尔质量比,混合气体的平均摩尔质量为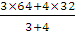 g·mol-1=
g·mol-1=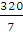 g·mol-1,混合气体与氧气的摩尔质量比为
g·mol-1,混合气体与氧气的摩尔质量比为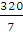 ∶32=
∶32=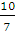 ∶1,所以混合气体的密度是氧气密度的
∶1,所以混合气体的密度是氧气密度的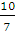 倍。
倍。
(3)根据稀释前后硫酸的物质的量不变可知:
2.4 mol·L-1×V=0.100 L×0.2 mol·L-1,V=0.008 3 L,故需要量取2.4 mol·L-1的H2SO4溶液的体积是8.3 mL。
(4)误差分析根据公式c= 进行分析,若未洗涤烧杯和玻璃棒,则n减小,V不变,c偏低;若定容时俯视,则使所加溶液体积变小,n不变,V减小,c偏高;若摇匀后发现低于液面再加蒸馏水,则会使V变大,由于n不变,则c偏低。
进行分析,若未洗涤烧杯和玻璃棒,则n减小,V不变,c偏低;若定容时俯视,则使所加溶液体积变小,n不变,V减小,c偏高;若摇匀后发现低于液面再加蒸馏水,则会使V变大,由于n不变,则c偏低。
答案:(1)5∶4 5∶6 5∶4 4∶5 (2)3∶4 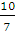
(3)8.3 (4)①偏低 ②偏高 ③偏低
【技法小结】配制溶液时判断误差的方法
判断误差时,一般是依据实验原理,对实验结果的数学表达式进行分析,找出自变量和因 变量的简单关系(成正比或反比)。配制一定物质的量浓度的溶液时,可以由cB=
变量的简单关系(成正比或反比)。配制一定物质的量浓度的溶液时,可以由cB=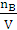 进行分析,cB与nB成正比,与V成反比,所以若某一操作引起nB增大,则结果偏高,反之则偏低;若某一操作引起V增大,则
进行分析,cB与nB成正比,与V成反比,所以若某一操作引起nB增大,则结果偏高,反之则偏低;若某一操作引起V增大,则 结果偏低,反之则偏高。
结果偏低,反之则偏高。


科目:高中化学 来源: 题型:
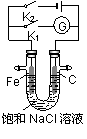
将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是
( )
A.K1闭合,K2断开,铁棒上发生的反应为2H2O+O2+4e-=4OH-
B.K2闭合,K1断开,电路中通过0.002 NA个电子时,两极共产生0.001 mol气体
C.K2闭合,K1断开,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K1闭合,K2断开,石墨棒周围溶液pH逐渐升高
查看答案和解析>>
科目:高中化学 来源: 题型:
关于油脂的说法中,不正确的是
( )
A.所有的油脂都能发生皂化反应
B.为了便于油脂的运输,工业上常常把液态油进行氢化
C.油脂都比水轻,浮在水面上
D.纯净的花生油不饱和度高,具有固定的熔、沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
①钠、氢气都能在氯气中燃烧生成白色烟雾
②铜丝在氯气中燃烧,生成蓝绿色的氯化铜
③液氯就是氯气的水溶液,它能使干燥的有色布条褪色
④久置的氯水,因氯气几乎完全挥发掉,剩下的只有水
A.① B.①和② C.①和④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
浓盐酸和Ca(ClO)2能发生反应:Ca(ClO)2+4HCl(浓)====CaCl2+2H2O+2Cl2↑,用久置漂白粉和浓盐酸反应得到的氯气中,可能含有的杂质气体是①CO2,②HCl,
③H2O,④O2( )
A.①②③ B.②③④
C.②③ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
同种物质中同一价态的元素部分被氧化,部分被还原的氧化还原反应是
( )
A.3Br2+6KOH====5KBr+KBrO3+3H2O
B.MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
C.2KNO3 2KNO2+O2↑
2KNO2+O2↑
D.NH4NO3 N2O↑+2H2O
N2O↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制取少量N2,常利用的反应是NaNO2+NH4Cl NaCl+N2↑+2H2O,关于该反应的说法正确的是( )
NaCl+N2↑+2H2O,关于该反应的说法正确的是( )
A.NaNO2是氧化剂
B.生成1 mol N2时转移的电子数为6 mol
C.NH4Cl中的氮元素被还原
D.N2既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
蔬菜、水果中富含纤维素,纤维素被食入人体后的作用是
( )
A.为人体内的化学反应提供原料
B.为维持人体生命活动提供能量
C.加强胃肠蠕动,具有通便功能
D.人体中没有水解纤维素的酶,纤维素在人体中没有任何作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com