
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是
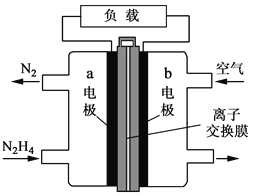
A. b极发生氧化反应
B. a极的反应式:N2H4+4OH--4e-=N2↑+4H2O
C. 放电时,电流从a极经过负载流向b极
D. 其中的离子交换膜需选用阳离子交换膜
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下: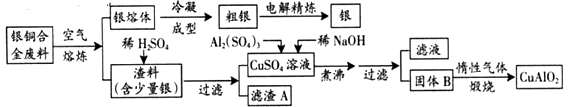
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)固体混合物B的组成为;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为。
(2)完成煅烧过程中一个反应的化学方程式:。
(3)若银铜合金中铜的质量分数为64%,理论上5.0kg废料中的铜可完全转化为CuAlO2 , 至少需要1.0mol·L-1的Al2(SO4)3溶液 L。
(4)某同学用FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
①FeCl3与H2S反应的离子方程式为。
②电解池中H+在阴极放电产生H2 , 阳极的电极反应为。
③综合分析实验II的两个反应,可知该实验有两个显著优点:
H2S的原子利用率100%;。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)为了检验和除去下表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内。
物质 | 检验试剂 | 除杂试剂 |
(Ⅰ)甲烷(乙烯) | ________。 | ________。 |
(Ⅱ)酒精(水) | ________。 | ________。 |
①检验试剂:
A.无水硫酸铜 B.酸性高锰酸钾溶液
C.水 D.氢氧化钠溶液
②除杂试剂:
a.无水硫酸铜 b.乙酸
c.新制的生石灰 d.溴水
除杂时,乙烯发生反应的化学方程式为____________________。
(2)如图,在左试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入3 mL浓硫酸,再加入2 mL乙酸,充分摇匀。按图连接好装置,用酒精灯对左试管小火加热3~5 min后,改用大火加热,当观察到右试管中有明显现象时停止实验。
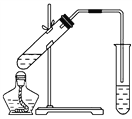
试回答:
在右试管中通常加入________溶液,实验生成的乙酸乙酯,其密度比水________,是有特殊香味的液体。分离右试管中所得乙酸乙酯的操作为(只填名称)________。反应中加入浓硫酸的作用是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是炼铜的最主要矿物,在野外很容易被误会为黄金,又称愚人金.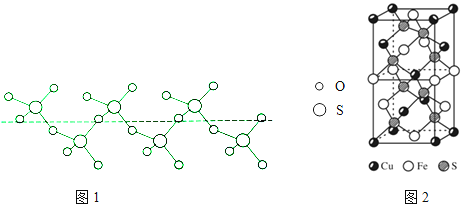
(1)火法冶炼黄铜矿的过程中,利用了Cu2O与Cu2S反应生成Cu单质,反应的化学方程式是
(2)S位于周期表中 族,该族元素氢化物中,H2Te比H2S沸点高的原因是 ,H2O比H2Te沸点高的原因是
(3)S有+4和+6两种价态的氧化物,回答下列问题:
①下列关于气态SO3和SO2的说法中,正确的是 .
A.中心原子的价层电子对数目相等 B.都是极性分子
C.中心原子的孤对电子数目相等 D.都含有极性键
②将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图1,此固态SO3中S原子的杂化轨道类型是
(4)Cu有+1和+2两种价态的化合物,回答下列问题:
①Cu+的价层电子排布为 ,Cu2+有 个未成对电子.
②新制的Cu(OH)2能够溶解于过量浓碱溶液中,反应的离子方程式是
(5)CuFeS2的晶胞如图2所示,晶胞参数a=0.524nm,c=1.032nm;CuFeS2的晶胞中每个Cu原子与 个S原子相连,列式计算晶体密度 ρ= gcm﹣3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安徽省具有丰富的铜矿资源,请回答下列有关铜及其化合物的问题,
(1)请写出基态Cu原子的外围电子排布式 . 焰火中的绿色是铜的焰色,基态铜原子在灼烧时外围电子发生了而变为激发态.
(2)新型农药松脂酸铜具有低残留的特点,图1是松脂酸铜的结构简式 
请分析1个松脂酸铜中π键的个数;加“*”碳原子的杂化方式为 .
(3)图2是某铜矿的晶胞图,请推算出此晶胞的化学式(以X表示某元素符号);与X等距离且最近的X原子个数为 .
(4)黄铜矿在冶炼的时候会产生副产品SO2 , SO2分子的几何构型 , 比较第一电离能:SO(填“>”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2。
![]() 请回答下列问题:
请回答下列问题:
![]() (1)电池的负极材料为 ,发生的电极反应为 ;
(1)电池的负极材料为 ,发生的电极反应为 ;
![]() (2)电池正极发生的电极反应为 ;
(2)电池正极发生的电极反应为 ;
![]() (3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 ;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 ;
![]() (4)组装该电池必须在无水、无氧的条件下进行,原因是 。
(4)组装该电池必须在无水、无氧的条件下进行,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组对生石灰与水反应是显著放热反应进行了实验探究,在除了用手触摸试管壁感觉发热外,还设计了下列几个可行性方案。
甲方案:将温度计与盛放有生石灰的小试管用橡皮筋捆绑在一起,放入有水的小烧杯中,用胶头滴管向小试管中缓缓滴入水,观察到的现象是_________、____________、________。说明反应放热。

乙方案:将盛放有生石灰的小试管插入带有支管的试管中,支管接①,用胶头滴管向小试管中缓缓滴入水,①中看到的现象是________________________________________,说明该反应放热。
丙方案:盛放有生石灰且带支管的试管中,支管接的导管中盛适量无水硫酸铜粉末,看到的现象是___________________________,说明反应放热,原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如图的反应关系:
(1)若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质.处理C物质可得到有价值的化学品,写出其中1种酸和1种盐的名称 .
(2)若B是气态氢化物.C、D是氧化物且会造成光化学烟雾污染.B与C在一定条件下反应生成的A是大气主要成分,写出该反应的化学方程式 .
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体.判断单质A的元素在周期表中的位置是 .写④反应离子方程式 .
(4)若A是太阳能电池用的光伏材料.C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性.写出②反应的化学方程式 .D的化学式是 .
(5)若A是应用最广泛的金属.④反应用到A,②⑤反应均用到同一种非金属单质.C的溶液用于蚀刻印刷铜电路板,写该反应的离子方程式 .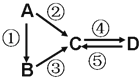
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道是稀硫酸中的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解。请你和他一起通过图Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。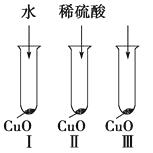
(1)该同学提出的假设是。
(2)通过实验Ⅰ可以证明。
(3)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步所做的确认实验为:在Ⅲ中先加入溶液,再加入溶液。
(4)探究结果为。你认为除实验Ⅱ和Ⅲ所用的试剂外,还能溶解氧化铜的一种常见物质是。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com