
反应CH3OH(l)+NH3(g)===CH3NH2(g)+H2O(g)在某温度自发向右进行,若反应的|ΔH|=17 kJ·mol-1,|ΔH-TΔS|=17 kJ·mol-1,则下列正确的是( )
A.ΔH>0,ΔH-TΔS<0 B.ΔH<0,ΔH-TΔS>0
C.ΔH>0,ΔH-TΔS>0 D.ΔH<0,ΔH-TΔS<0
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有____▲__性。
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:
2KClO3+SO2===2ClO2+______▲____。
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O +I2===S4O
+I2===S4O +2I-)
+2I-)
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如下图所示:

请回答:
①操作Ⅰ中反应的离子方程式是_____________▲_________________。
②确定操作Ⅱ完全反应的现象是_____________▲_________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是_______▲___________。
④若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是____▲____mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为( )
A.1∶1 B.1∶2
C.2∶3 D.3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
根据反应:2Ag++Cu===Cu2++2Ag,设计如图所示原电池,下列说法错误的是( )
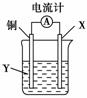
A.X可以是银或石墨
B.Y是硫酸铜溶液
C.电子从铜电极经外电路流向X电极
D.铜极上的电极反应式为:Cu-2e-===Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是稀硫酸与某金属反应的实验数据:
| 实验 序号 | 金属质量/g | 金属状态 | c(H2SO4) /mol·L-1 | V(H2SO4溶液)/mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
分析上述数据,回答下列问题:
(1)实验4和5表明,____________________对反应速率有影响,____________,反应速率越快,能表明同一规律的实验还有________(填实验序号)。
(2)仅表明反应物浓度对反应速率产生影响的实验有__________________(填实验序号)。
(3)本实验中影响反应速率的其他因素还有________,其实验序号是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
2SO2(g)+O2(g) 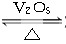 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=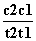
查看答案和解析>>
科目:高中化学 来源: 题型:
在相同温度和压强下,对反应CO2(g)+H2(g)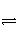
 CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
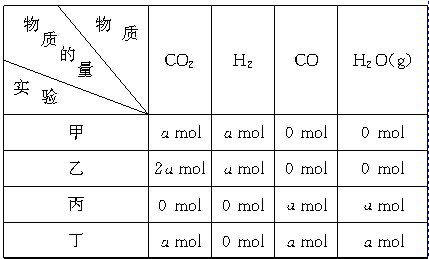
上述四种情况达到平衡后,n(CO)的大小顺序是( )
A.乙=丁>丙=甲 B.乙>丁>甲>丙
C.丁>乙>丙=甲 D.丁>丙>乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学反应2A===B+D在四种不同条件下进行。B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
| 实验序号 | 温度 | 0 min | 10min | 20min | 30min | 40min | 50min | 60min |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)在实验1中,反应在10至20 min时间内平均速率为________mol·L-1·min-1。
(2)在实验2中,A的初始浓度c2=______mol·L-1,反应经20 min就达到平衡,可推测实验2中还隐含的条件是____________________________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3______v1(填“>”、“=”或“<”),且c3______1.0 mol·L-1(填“<”、“=”或“>”)。
(4)比较实验4和实验1,可推测该反应是________反应(填“吸热”或“放热”),理由是________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
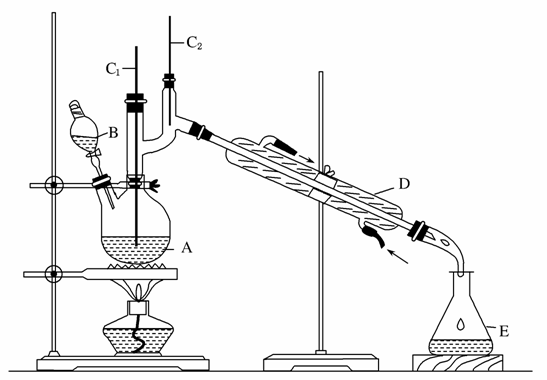
发生的反应如下:
CH3CH2CH2CH2OH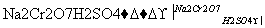 CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
| 正丁醇 | 11.72 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:
将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在E中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77 ℃馏分,产量2.0 g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由______
_______________________________________________。
(2)加入沸石的作用是________。若加热后发现未加沸石,应采取的正确方法是____________________________________________。
(3)上述装置图中,B仪器的名称是________,D仪器的名称是________。
(4)分液漏斗使用前必须进行的操作是________(填正确答案标号)。
a.润湿 b.干燥
C.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在________层(填“上”或“下”)。
(6)反应温度应保持在90~95 ℃,其原因是_________________。
(7)本实验中,正丁醛的产率为________%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com