
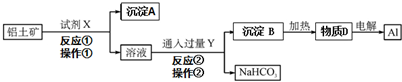
分析 Fe2O3和氢氧化钠不反应而氧化铝能反应,向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀,过滤得到氢氧化铝的沉淀,再加热分解得到氧化铝,最后电解得到铝单质,据此分析.
解答 解:(1)Fe2O3和氢氧化钠不反应而氧化铝能反应,所以X是NaOH,得到的滤液是偏铝酸钠,向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀,过滤得到氢氧化铝的沉淀,所以试剂X为NaOH;操作②的名称为过滤;故答案为:NaOH;过滤;
(2)向偏铝酸钠中通入过量的二氧化碳反应的实质是:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
点评 此题是一道物质的制备考查题,根据图示中物之间的反应情况对相关的问题进行探讨分析即可.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变某平衡体系的温度 | |
| B. | 有气态物质参加的可逆反应达到平衡后,改变压强 | |
| C. | 使平衡混合物中各组分的浓度发生变化 | |
| D. | 可逆反应达到平衡后,使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 降低温度将缩短反应达到平衡的时间 | |
| B. | 增大反应体系的压强反应速率一定增大 | |
| C. | 催化剂V2O5同时改变正逆反应速率 | |
| D. | 增加O2的浓度将提高SO2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 环保热词“PM2.5”是指大气中直径小于或等于2.5 微米(1微米=1×10-6米)的颗粒,“PM2.5”与空气形成的分散系属于胶体 | |
| B. | 食盐中加入少量碘化钾,食用后可补充人体内碘元素的不足 | |
| C. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量,石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 | |
| D. | 晶体硅是通信工程中制作光导纤维的主要原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
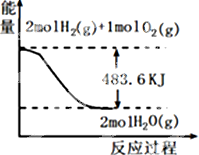
| A. | 表示1mol H2(g)完全燃烧生成水蒸气吸收241.8 kJ热量 | |
| B. | 表示的热化学方程式为:H2(g)+$\frac{1}{2}$ O2(g)=H2O(g)△H=-241.8 kJ•mol-1 | |
| C. | H2O(g)的能量低于H2(g)和O2(g)的能量之和 | |
| D. | 表示2 mol H2(g)所具有的能量一定比2 mol气态水所具有的能量多483.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
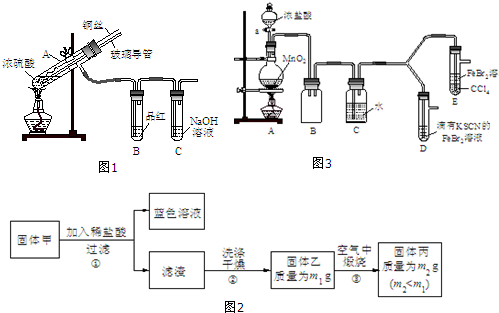
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯. | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,CCl4层无明显变化. | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: Cl2>Br2>Fe3+ |
| ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. ⅱ.Cl2和Br2反应生成的BrCl呈红色,沸点约5℃,与水发生水解反应. ⅲ.AgClO、AgBrO均可溶于水. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的化学性质完全不同 | B. | 它们是碳元素的三种同位素 | ||
| C. | 它们是碳元素的三种单质 | D. | 它们是碳元素的同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com