
| A、4:3 | B、3:4 |
| C、2:1 | D、1:2 |
| V |
| Vm |
| 13.44L |
| 22.4L/mol |


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
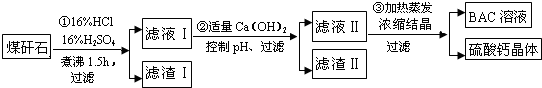
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L0.1mol/LKCl溶液 |
| B、0.2L0.2mol/L的盐酸溶液 |
| C、0.1L0.1mol/L的AlCl3溶液 |
| D、0.3L0.1 mol/L的MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、3:8 |
| C、2:3 | D、8:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,28gFe与足量的浓硝酸反应,转移的电子数为1.5NA |
| B、标准状况下,含4molHCl的浓盐酸与足量MnO2反应可生成22.4LCl2 |
| C、3.2g铜在硫蒸气中完全燃烧,转移的电子数为0.1NA |
| D、常温常压下,0.1mol氖气含有的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分散质粒子直径介于1~100 nm之间的分散系称为胶体 |
| B、江河入海口三角洲的形成通常与胶体的性质有关 |
| C、用激光笔检验淀粉溶液的丁达尔效应 |
| D、向煮沸的1 mol?L-1 NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 a~e是元素周期表中前四周期元素,请根据表中信息回答下列问题:
a~e是元素周期表中前四周期元素,请根据表中信息回答下列问题:| 元素 | 元素相关信息 |
| a | 其单质的熔点97.81℃,沸点882.9℃,在氧气中燃烧得到淡黄色固体 |
| b | 原子核外有7种运动状态不同的电子 |
| c | 电负性最大 |
| d | 一种核素的质量数为35,中子数为18 |
| e | 基态原子的核外电子排布中未成对的电子数最多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com