



 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ͭм����Fe3+��Һ�У�2Fe3++Cu=2Fe2++Cu2+ |
| B����С�մ�����θ����ࣺHCO3-+H+=CO2��+H2O |
| C�������Ƶ�ˮ�⣺CH3COO-+H3O+?CH3COOH+H2O |
D����������Һ��ͨ��CO2���壺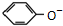 +CO2+H2O�� +CO2+H2O�� +HCO3- +HCO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ѡ�� | ʵ����� | ʵ������ | ���� |
| A | ����Һ�м���Na2CO3��Һ | ��Һ����� | ���ԣ����ӣ�HCO3- |
| B | ���Ҵ��м���ŨH2SO4�����ȣ���Һ��ڣ�������������ͨ������KMnO4��Һ | KMnO4��Һ ��ɫ |
����������ϩ |
| C | ����ҺX�еμ�NaOHϡ��Һ����ʪ��ĺ�ɫʯ����ֽ�����Թܿ� | ��ֽ������ | ��ҺX����NH4+ |
| D | ��ʪ��ĵ��۵⻯����ֽ��������Y | ��ֽ���� | ����Y��Cl2 |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ������Ũ�ȣ�mol/L�� �¶ȣ��棩 ʱ�䣨min�� |
15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 0.9��10-3 | 2.7��10-3 | 8.1��10-3 |
| t2 | 2.4��10-3 | 4.8��10-3 | 9.4��10-3 |
| t3 | 2.4��10-3 | 4.8��10-3 | 9.4��10-3 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ϩ �� �� �� �� | �� �� �� �� |
| ��CH3��2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| TiCl4 | Mg | MgCl2 | Ti | |
| �۵�/�� | -25.0 | 648.8 | 714 | 1667 |
| �е�/�� | 136.4 | 1090 | 1412 | 3287 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ij�������������������ӳɷ�Ӧ�ɵõ��ṹ��ʽΪ����ͼ������������˲���������Ϊϩ�����ܵĽṹ��ʽ��
ij�������������������ӳɷ�Ӧ�ɵõ��ṹ��ʽΪ����ͼ������������˲���������Ϊϩ�����ܵĽṹ��ʽ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ڢۢ� | B���ڢۢ� |
| C���ڢܢ� | D���٢ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com