


 ��Ȥ����¹�֪��ϵ�д�
��Ȥ����¹�֪��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������β���ľ�����Ӧ��2NO (g)��2CO(g)��N2(g)��2CO2(g)
���ȣ���113.0 kJ��mol��1 ���ӣ���145.3 J��mol��1��K ��1����298�ˡ�101kPa�£��ٶ���Ӧ�ʱ����ر䲻���¶ȱ仯��ͨ������˵���÷�Ӧ���������ܲ����Է����У�����˷�Ӧ�Է����е��¶ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ���㽭ʡ������³Ѹ��ѧ�߶���ѧ����ĩ���Ի�ѧ�Ծ����������� ���ͣ��ʴ���
��12�֣�
��1���������²��0.1mol��L-1��ˮPH=11������¶��°�ˮ�ĵ����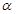 =__________
=__________
��2��25��ʱ��0.1mol��L-1��H2Aˮ��Һ�У�������������������Һ��pH���õ����к�H2A��HA-��A2-����������Һ��
�ٵ���Һ��pH=7ʱ��c��Na+��=__________�����������Ĺ�ϵ��
�ڵ�c��Na+��=c��A2-��+c��HA-��+c��H2A��ʱ��ҺΪ__________��Һ�������ʣ���
��3���£�N2H4���ֳ���������һ�ֿ�ȼ�Ե�Һ�壬���������ȼ�ϡ���֪��101kPaʱ��32.0gN2H4����������ȫȼ�����ɵ�����Һ̬ˮ���ų�����624kJ��25��ʱ����N2H4��ȫȼ�շ�Ӧ���Ȼ�ѧ����ʽ��__________��
��4���״�������ȼ�ϵ����һ�ָ�Ч�ܡ�����Ⱦ�綯�����ij��ص�أ���ȼ�ϵ�صĵ�ط�ӦʽΪ��2CH3OH+3O2=2CO2+4H2O���乤��ԭ��ʾ��ͼ���£�����a��b��c��d�ĸ�����ڱ�ʾͨ����ų������ʣ���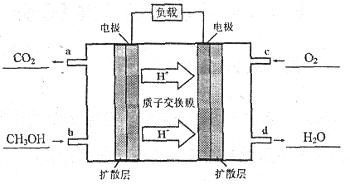
���ĵ缫��ӦʽΪ__________�������ĵ缫��ӦʽΪ__________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013���㽭ʡ�����и߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
��12�֣�
��1���������²��0.1mol��L-1��ˮPH=11������¶��°�ˮ�ĵ���� =__________
=__________
��2��25��ʱ��0.1mol��L-1��H2Aˮ��Һ�У�������������������Һ��pH���õ����к�H2A��HA-��A2-����������Һ��
�ٵ���Һ��pH=7ʱ��c��Na+��=__________�����������Ĺ�ϵ��
�ڵ�c��Na+��=c��A2-��+c��HA-��+c��H2A��ʱ��ҺΪ__________��Һ�������ʣ���
��3���£�N2H4���ֳ���������һ�ֿ�ȼ�Ե�Һ�壬���������ȼ�ϡ���֪��101kPaʱ��32.0gN2H4����������ȫȼ�����ɵ�����Һ̬ˮ���ų�����624kJ��25��ʱ����N2H4��ȫȼ�շ�Ӧ���Ȼ�ѧ����ʽ��__________��
��4���״�������ȼ�ϵ����һ�ָ�Ч�ܡ�����Ⱦ�綯�����ij��ص�أ���ȼ�ϵ�صĵ�ط�ӦʽΪ��2CH3OH+3O2=2CO2+4H2O���乤��ԭ��ʾ��ͼ���£�����a��b��c��d�ĸ�����ڱ�ʾͨ����ų������ʣ���
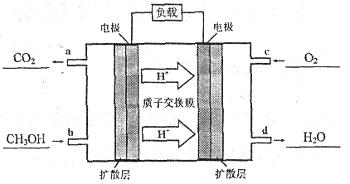
���ĵ缫��ӦʽΪ__________�������ĵ缫��ӦʽΪ__________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com