
| A. | 反应结束后溶液的pH:甲>乙 | |
| B. | 反应开始时的速率:甲>乙 | |
| C. | 反应所需时间:甲<乙 | |
| D. | 反应开始时,酸的物质的量浓度:甲>乙 |
分析 HCl是强电解质、醋酸是弱电解质,所以pH相等的盐酸和醋酸,甲的物质的量浓度大于乙,分别与锌反应,若最后锌已全部溶解且放出气体一样多,说明二者消耗锌和酸的物质的量一样多,可能存在的情况是:锌不足量,盐酸和醋酸都有剩余;或是锌不足量,盐酸恰好反应、醋酸过量;或是锌过量,盐酸和醋酸都不足;
A.根据反应后溶液中的溶质判断溶液pH大小;
B.反应速率与氢离子浓度成正比;
C.随着反应的进行,醋酸电离出氢离子,导致醋酸溶液中氢离子浓度大于盐酸;
D.pH相等的醋酸和盐酸,醋酸的物质的量浓度大于盐酸.
解答 解:HCl是强电解质、醋酸是弱电解质,所以pH相等的盐酸和醋酸,甲的物质的量浓度大于乙,分别与锌反应,若最后锌已全部溶解且放出气体一样多,说明二者消耗锌和酸的物质的量一样多,可能存在的情况是:锌不足量,盐酸和醋酸都有剩余;或是锌不足量,盐酸恰好反应、醋酸过量;或是锌过量,盐酸和醋酸都剩余;
A.如果锌不足量,盐酸和醋酸都有剩余,则醋酸剩余酸的量远远大于盐酸,所以醋酸pH较小;如果是锌不足量,盐酸恰好反应、醋酸过量,测醋酸酸性大于盐酸,醋酸溶液pH较小;如果锌过量,盐酸和醋酸都不足,醋酸根离子水解程度大于盐酸,所以醋酸溶液pH较小,故A正确;
B.反应速率与氢离子浓度成正比,开始时氢离子浓度相等,所以反应速率相等,故B错误;
C.随着反应的进行,醋酸电离出氢离子,导致醋酸溶液中氢离子浓度大于盐酸,所以反应过程中醋酸反应速率大于盐酸,则反应所需时间:甲>乙,故C错误;
D.HCl是强电解质完全电离、醋酸是弱电解质部分电离,所以pH相等的醋酸和盐酸,醋酸的物质的量浓度大于盐酸,故D错误;
故选A.
点评 本题考查弱电解质的电离,侧重考查学生分析判断能力,明确弱电解质的电离特点是解本题关键,注意要分情况讨论,易错选项是A,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
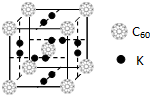 碳元素是构成物质种类最多的一种元素,许多物质与我们的生活息息相关.
碳元素是构成物质种类最多的一种元素,许多物质与我们的生活息息相关. ,该物质的K原子和C60分子的个数比为3:1.
,该物质的K原子和C60分子的个数比为3:1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃烧反应都是放热反应 | |
| B. | 对于可逆反应:aA(g)+bB(g)?bC(g)+dD(g),如果正反应放热,逆反应一定吸热 | |
| C. | 氢气燃烧生成水是一个放热的化学反应,说明1 mol H2的能量高于1 mol H2O的能量 | |
| D. | 只有放热的氧化还原反应才可以设计为原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①④⑥ | C. | ②④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COO- Na+ NO3- Cl- | B. | K+ Na+ Cl- NO3- | ||
| C. | K+ Na+ Cl- AlO2- | D. | K+ I- SO42- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y形成化合物时X显负价,Y显正价 | |
| B. | 第一电离能X大于Y | |
| C. | 最高价氧化物对应的水化物的酸性:X强于Y | |
| D. | 气态氢化物的稳定性:HmX强于HmY |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
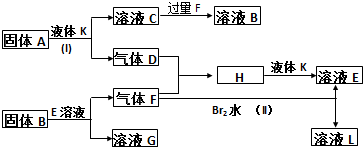
 ;所含化学键类型为离子键、共价键(或离子键、非极性键);A晶体的晶胞中阳离子和阴离子的个数比为2:1.
;所含化学键类型为离子键、共价键(或离子键、非极性键);A晶体的晶胞中阳离子和阴离子的个数比为2:1. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com