
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4②1s22s22p63s23p3③1s22s22p3④1s22s22p5
则下列有关比较中正确的是
A. 第一电离能:④>③>②>① B. 原子半径:④>③>②>①
C. 电负性:④>③>②>① D. 最高正化合价:④>③=②>①
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源:2015-2016学年浙江省海宁市三校高二下学期期中化学试卷(解析版) 题型:选择题
已知H2(g)+Br2(g)=2HBr(g) △H=-102 kJ·mol-1,其它相关数据如下表:
H2(g) | Br2(g) | HBr(g) | ||
1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 | |
则表中a为
A.230 B.200 C.404 D.260
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高二上学期期中理化学试卷(解析版) 题型:选择题
下列热化学方程式中,表示燃烧热的热化学方程式的是( )
A.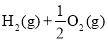 ═
═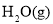
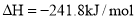
B. ═
═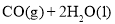
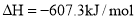
C.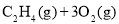 ═2CO2(g)+2H2O(l)
═2CO2(g)+2H2O(l) 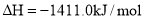
D.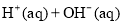 ═
═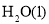
查看答案和解析>>
科目:高中化学 来源:2017届陕西省宝鸡市岐山县高三上期中化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的数值,下列说法正确的是
A.标准状况下,22.4LCCl4含有NA个分子
B.0.1molAlCl3完全转化为氢氧化铝胶体,生成0.l NA个胶体粒子
C.常温常压下46gNO2和N2O4混合气体含有3NA个原子
D.0.1molCl2与足量NaOH溶液反应,转移电子数为0.2 NA
查看答案和解析>>
科目:高中化学 来源:2017届山西省协作体高三上期中化学试卷(解析版) 题型:推断题
化合物Ⅰ(C11H12O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基。Ⅰ可以用E和H在一定条件下合成:
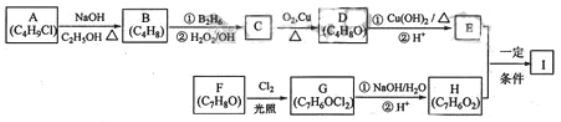
已知以下信息:
A的核磁共振氢谱表明其只有一种化学环境的氢;
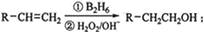
化合物F苯环上的一氯代物只有两种;
通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
回答下列问题:
(1)A的化学名称为_________________。
(2)D的结构简式为_________________。
(3)E的分子式为___________________。
(4)F生成G的化学方程式为_______________,该反应类型为__________。
(5)I的结构简式为_________________。
(6)I的同系物J比I相对分子质量小14,J的同分异构体中能同时满足如下条件:
①苯环上只有两个取代基,②既能发生银镜反应,又能和饱和NaHCO3溶液反应放出CO2,共有__________种(不考虑立体异构)。J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式______________。
查看答案和解析>>
科目:高中化学 来源:2017届山西省协作体高三上期中化学试卷(解析版) 题型:选择题
已知某药物具有抗痉挛作用,制备该药物其中一步反应为:
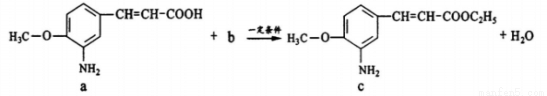
下列说法不正确的是
A.a中参加反应的官能团是羧基
B.生活中b可作燃料和溶剂
C.c极易溶于水
D.该反应类型为取代反 应
应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省龙岩四校高二上学期期中联考化学试卷(解析版) 题型:选择题
难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
TaS2(g)+2I2(g)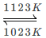 TaI4(g)+S2(g)
TaI4(g)+S2(g)

下列说法正确的是 ( )
A.在不同温度区域,TaI4 的量保持不变
B.在提纯过程中,I2 的量不断减少
C.在提纯过程中,I2的作用是将TaS2 从高温区转移到低温区
D.该正反应的平衡常数与TaI4 和S2 的浓度乘积成反比
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省宣城市等四校高二上期中化学卷(解析版) 题型:填空题
合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
一种工业合成氨的简易流程图如下:

(1)在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)当反应达到平衡时,N2和H2的浓度比是 。升高平衡体系的温度(保持体积不变),该反应 (填“逆向移动”正向移动”或“不移动”) 。
2NH3(g)(正反应为放热反应)当反应达到平衡时,N2和H2的浓度比是 。升高平衡体系的温度(保持体积不变),该反应 (填“逆向移动”正向移动”或“不移动”) 。
(2)氨水、氯水中均存在多种微粒和多个平衡,请写出氯水中存在的一个化学平衡反应的离子方程式 。
(3)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是___________。
a.升高温度 b.增大压强
c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若2 mol CO和H2的混合气体(H2的体积分数为80%)与H2O反应,得 到2.28mol CO、CO2和H2的混合气体,则CO转化率为_____________。
到2.28mol CO、CO2和H2的混合气体,则CO转化率为_____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省、永年二中高一上期中化学卷(解析版) 题型:选择题
下列说法正确的是(设阿伏加德罗常数的数值为NA)( )
A.在标准状况下,22.4L水所含分子数目为NA
B.1mol·L-1 K2SO4溶液所含K+数目为2NA
C.1 mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为N A
D.O2的摩尔体积约为22.4 L·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com