
一定温度下,在一定容积的密闭容器中发生如下可逆反应:
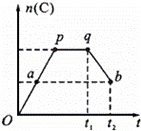
2A(g)+B(g)⇌2C(g),在反应过程中,C的物质的量n(C)随时间的变化关系如下图所示(从t1时间开始对反应体系升高温度).试回答下列问题:
(1)a点时,反应的v(正) v(逆)(填“>”、“<”或“=”);
(2)此反应的逆反应为 热反应(填“放”或“吸”);
(3)a、b两点的正反应速率:v(a) v(b)(填“>”、“<”或“=”).
考点:
物质的量或浓度随时间的变化曲线.
专题:
化学平衡专题.
分析:
(1)根据图象曲线的变化可知,该反应在P点时达到平衡状态,从a到p的过程中C的物质的量逐渐增大,则反应向着正向移动,正反应速率大于逆反应速率;
(2)p、q时间段该反应处于平衡状态,从t1时间开始对反应体系升高温度,C的物质的量减小,说明平衡向着逆向移动,逆反应方向为吸热反应;
(3)a、b两点C的物质的量相同,则a、b两点A、B的物质的量也一定相等,但是t2温度高于t1,据此判断a、b两点的正反应速率大小.
解答:
解:(1)根据图象可知,从O到P的过程中,C的物质的量逐渐增大,则反应向着正向移动,所以在a点时正反应速率大于逆反应速率,即:v(正)>v(逆),
故答案为:>;
(2)根据C的物质的量n(C)随时间的变化关系图可知,从t1时间开始对反应体系升高温度,C的物质的量减小,则说明升高温度,平衡向着逆向移动,逆反应方向为吸热反应,
故答案为:吸;
(3)结合图象可知,a、b两点时C的物质的量相同,则a、b两点时A、B的物质的量也一定相等,但是由于t2温度高于t1,则反应速率v(a)<v(b),
故答案为:<.
点评:
本题考查了化学平衡与化学反应速率的综合应用,题目难度中等,注意掌握影响化学平衡、化学反应速率的因素,明确温度、压强等对化学平衡、化学反应速率的影响,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
下表中物质的分类组合完全正确的是()
选项 A B C D
强电解质 KNO3 H2SO4 BaSO4 HClO4
弱电解质 HF CaCO3 HClO CH3COONH4
非电解质 SO2 金属Al H2O C2H5OH
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用标准盐酸溶液测定某NaOH溶液的浓度.用甲基橙作指示剂,下列操作可能使测定结果偏低的是( )
|
| A. | 酸式滴定管用蒸馏水洗涤后未用标准液清洗 |
|
| B. | 开始实验时,酸式滴定管尖咀部份有气泡,在滴定过程中气泡消失 |
|
| C. | 滴定过程中,锥形瓶内溶液颜色由黄色变为橙色,但又立即变为黄色,此时便停止滴定,记录读数 |
|
| D. | 达到滴定终点时,仰视读数并记录 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 单质铯的熔点比单质锂的高 |
|
| B. | 胶体的胶粒不能通过滤纸 |
|
| C. | 元素N的氢化物的沸点比元素P的氢化物的沸点低 |
|
| D. | 用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
蓄电池在放电时起原电池作用,在充电时起电解池的作用.下式是爱迪生蓄电池分别在充电和放电时的反应:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2则下列有关对爱迪生蓄电池的推断错误的是( )
Fe(OH)2+Ni(OH)2则下列有关对爱迪生蓄电池的推断错误的是( )
|
| A. | 放电时正极附近pH增大 |
|
| B. | 充电时阴极的电极反应式为:Fe(OH)2+2e﹣═Fe+2OH﹣ |
|
| C. | 放电时电解质溶液中的阴离子向正极方向移动 |
|
| D. | 蓄电池的电极可浸入某种碱性电解质溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在某容积可变的密闭容器中,有下列的可逆反应:A(g)+B(g)⇌xC(g),有图1(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线.若试判断对图2的说法中正确的是( )
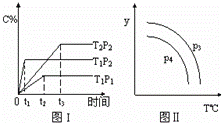
|
| A. | P3>P4,y轴表示C的体积分数 |
|
| B. | P3<P4,y轴表示B的质量分数 |
|
| C. | P3<P4,y轴表示混合气体的密度 |
|
| D. | P3>P4,y轴表示混合气体的平均摩尔质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z在周期表中的位置关系如图所示,则下列叙述中正确的是()
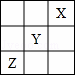
A. Z一定是活泼的金属元素
B. Y的最高价氧化物的水化物是一种强酸
C. Y的氢化物稳定性大于Z的氢化物稳定性
D. X、Y、Z各元素的最高正价与最低负价的绝对值之和均为8
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是()
A. 稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑
B. 氢氧化钡与稀硫酸混合:SO42﹣+H++OH﹣+Ba2+=H2O+BaSO4↓
C. 用稀硫酸洗去铁锈:Fe2O3+6H+=2 Fe3++3H2O
D. 石灰乳与Na2CO3溶液混合:Ca2++CO32﹣=CaCO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
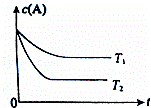
反应A(g)⇌B(g)+C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L.温度T1和T2下A的浓度与时间关系如右图所示.回答下列问题:
(1)上述反应的温度T1小于 T2,平衡常数K(T1) K(T2).(填“大于”、“小于”或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为 .
②反应的平衡常数K= .
③反应在0~5min区间的平均反应速率v(A)= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com