
亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及生成气体产物的成分。已知:①NO+NO2+2OH-=2NO2-+2H2O
②气体液化的温度:NO2 21℃、NO -152℃
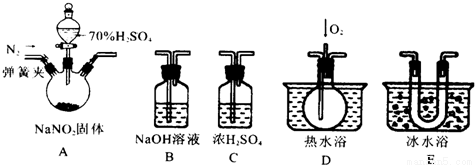
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→C→_______→_______→_______;组装好仪器后,接下来进行的操作是________________。
(2)关闭弹簧夹,打开分液漏斗活塞,滴入70%的硫酸后, A中产生红棕色气体.
①确认A中产生气体含有NO,依据的现象是___________________
②装置E的作用是______________________
(3)如果向D中通入过量O2,则装置B中发生反应的化学方程式为________________.
如果没有装置C,对实验结论造成的影响是______________________。
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是_______________。
(5)工业生产中氮氧化物的排放会造成环境污染,可采用如下方法处理氮氧化物:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol-1
则CH4将NO2还原为NO的热化学方程式为:____________________。
科目:高中化学 来源:2015-2016学年吉林省高二上学期第三次月考化学试卷(解析版) 题型:填空题
写出下列电极方程式书写:
(1)酸性电解质的条件下氢氧燃料电池负极的电极方程式 ;正极的电极方程式 ;
(2)氢氧化钾做电解质条件下写出甲醇(CH3OH)的燃料电池的负极的电极方程式 ;正极的电极方程式 ;
(3)写出碱性锌锰原电池的负极的电极方程式 ;正极的电极方程式 ;
(4)写出铅蓄电池放电的负极的电极反应方程式 ;
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上第二次阶段测化学试卷(解析版) 题型:填空题
氯酸钠(NaClO3)是无机盐工业的重要产品之一。
(1)工业上制取氯酸钠采用在热的石灰乳中通入氯气,然后结晶除去氯化钙后,再加入适量的 (填试剂化学式),过滤后即可得到。
(2)实验室制取氯酸钠可通过如下反应:3C12+6NaOH 5NaC1+NaC1O3+3H2O,先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如右图所示,图中C表示的离子是 。
5NaC1+NaC1O3+3H2O,先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如右图所示,图中C表示的离子是 。

(3)某企业采用无隔膜电解饱和食盐水法生产氯酸钠。则反应化学方程式为: 。
(4)样品中C1O3-的含量可用滴定法进行测定,步骤如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液。
步骤2:从上述容量瓶中取出10.00mL溶液于锥形瓶中,准确加入25mL 1.000mol/L(NH4)2Fe(SO4)2溶液(过量),再加入75mL硫酸和磷酸配成的混酸,静置10min。
步骤3:再在锥形瓶中加入100mL蒸馏水及某种指示剂,用0.0200mol/L K2Cr2O7标准溶液滴定至终点,消耗体积15.62mL。
步骤4: 。
步骤5:数据处理与计算。
①步骤2中反应的离子方程式为 ;静置10min的目的是 。
②步骤3中K2Cr2O7标准溶液应盛放在 (填仪器名称)中。
③为精确测定样品中C1O3-的质量分数,步骤4操作为 。
(5)在上述操作无误的情况下,所测定的结果偏高,其可能的原因的原因是
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省沈阳市四校协作体高三上学期期中联考化学试卷(解析版) 题型:实验题
某校兴趣小组对SO2与新制Cu(OH)2悬浊液的反应进行探究,实验如下:
装置 | 序号 | 试管中的药品 | 现象 |
持续通入
| 实验Ⅰ | 1.5 mL 1 mol?L-1 CuSO4溶液和3.5 mL 1 mol?L-1 NaOH溶液混合 | 开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,静置,试管底部有少量紫红色固体,溶液呈绿色 |
实验Ⅱ | 1.5 mL 1 mol?L-1 CuCl2溶液和3.5 mL 1 mol?L-1 NaOH溶液混合 | 开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈绿色 |
(1)制取新制Cu(OH)2悬浊液的离子方程式为 。
(2)甲同学重新用实验II的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净。向洗净后的Cu(OH)2中加入5 mL蒸馏水,再持续通入SO2气体,现象与实验I相同,此步实验证明: 。检验Cu(OH)2洗涤干净的方法是 。
(3)同学们对白色沉淀的成分继续进行探究。查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸。它与氨水反应生成Cu(NH3)2+,在空气中会立即被氧化成含有蓝色Cu(NH3)42+溶液。
①甲同学向洗涤得到的白色沉淀中加入氨水,得到蓝色溶液,此过程中反应的离子方程式为:CuCl + 2NH3·H2O = Cu(NH3)2+ + Cl- + 2H2O 、 ____________ 。
②乙同学用另一种方法证明了该白色沉淀为CuCl,实验方案如下:

填写下表空格:
试剂1 | 试剂2 | 蒸馏水 | |
现象1 | 现象2 |
③写出实验II中由Cu(OH)2生成白色沉淀的离子方程式: 。
(4)丙同学通过实验证明实验Ⅰ中观察到的砖红色沉淀是Cu2O。完成合理的实验方案:取少量Cu2O固体于试管中, _______________ ,则说明砖红色沉淀是Cu2O。
查看答案和解析>>
科目:高中化学 来源:2016届上海市十三校高三上学期第一次联考化学试卷(解析版) 题型:选择题
青蒿琥酯是治疗疟疾的首选药,可由青蒿素两步合成得到。下列有关说法正确的是

A.青蒿素分子式为C15H22O5
B.青蒿素不能与NaOH溶液反应
C.反应②原子利用率为100%
D.青蒿琥酯能与氢氧化钠溶液反应可生成青蒿琥酯钠
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期第三次月考化学试卷(解析版) 题型:填空题
“2015.8.12”天津港爆炸中有一定量的氰化物泄露。氰化物多数易溶于水,有剧毒,易造成水污染。已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 ( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
(1)根据价键规则,写出HCN的结构式是 ;
(2)下列能用于判断氮、碳两种元素非金属性强弱的是________。(填序号)
a.气态氢化物沸点
b.最高价氧化物对应水化物酸性强弱
c.Al2O3 + N2 + 3C == 2AlN + 3CO
d.单质晶体类型
(3)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是 ;通过列式计算“c(CN-)与c(HCN)”的大小 判断:c(CN-) c(HCN)(填“>”、“<”或“=”)
(4)含CN﹣的污水危害很大,处理该污水时,可在催化剂TiO2作用下用NaClO将CN﹣氧化成CNO﹣。CNO﹣在酸性条件下继续被NaClO氧化生成N2与CO2.某环保部门用下图装置进行实验,以证明该处理方法的有效性并测定CN﹣被处理的百分率。

将浓缩后含CN﹣的废水与过量NaClO溶液的混合液(其中CN﹣浓度为0.05mol/L)200mL倒入甲中,塞上橡皮塞,一段时间后,打开活塞,使溶液全部放入乙中,关闭活塞。
①甲中反应的离子方程式为 ;乙中反应的离子方程式为 。
②乙中生成的气体除CO2、N2外还有HCl及副反应生成的Cl2等,上述实验是通过测定CO2的量来确定CN﹣的处理效果.丙中加入的除杂试剂是 (填标号)。
(A)饱和食盐 (B)饱和NaHCO3溶液 (C)浓NaOH溶液 (D)浓硫酸
丁在实验中的作用是 。戊中盛有足量的石灰水,若实验后戊中共生成0.8g沉淀,则该实验中CN﹣被处理的百分率 80%(填“>”、“二”或“<”=)。
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三上学期第三次月考理综化学试卷(解析版) 题型:填空题
维拉左酮是临床上使用广泛的抗抑郁药,其关键中间体合成路线如如:
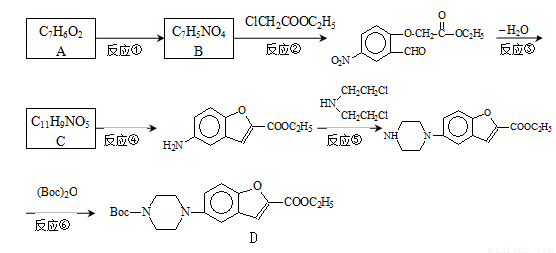
已知:①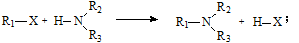
②
(1)反应类型:反应④ 反应⑤
(2)结构简式:A C
(3)写出反应②的化学方程式: 。
实验中反应②必须在碳酸钾弱碱性条件下进行的原因是 。
(4)合成过程中反应③与反应④不能颠倒的理由为 。
(5)反应⑥中,(Boc)2是有由两分子C5H10O3脱水形成的酸酐,写出分子式为C5H10O3,且分子中只含有2种不同化学环境氢原子,能发生水解反应的结构简式(书写2种): 、 。
(6)实验室还可以用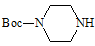 和
和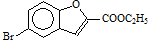 直接反应生成D,但实验中条件控制不当会发生副反应生成副产物,写出副产物有机物的结构简式 。
直接反应生成D,但实验中条件控制不当会发生副反应生成副产物,写出副产物有机物的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建晨曦、冷曦、正曦、岐滨四校高二上联考化学卷(解析版) 题型:选择题
下列叙述正确的是
A.常温下,pH值等于14与pH值等于12的两种NaOH溶液等体积混和后,c(H+)=(10-14+10-10)/2
B.常温下,浓度为1×10-10mol/L的KOH溶液的pH值最接近于4
C.氨水加水稀释,溶液中除水以外的所有粒子的浓度都减小
D.常温下,相同温度下pH值等于1的盐酸溶液中水的电离程度与pH值等于13的Ba(OH)2溶液中水的电离程度相等
查看答案和解析>>
科目:高中化学 来源:2016届安徽省皖江名校高三上学期12月联考化学试卷(解析版) 题型:选择题
运用有关概念判断下列说法正确的是
A.NH4Cl中有离子键,是离子化合物
B.46g C2H5OH燃烧放出的热量为乙醇的燃烧热
C.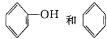 互为同系物
互为同系物
D.绿色化学的核心是应用化学原理对环境污染进行治理
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com