
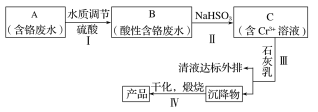
”¾ĢāÄæ”æijøõŃĪ³§¾»»Æŗ¬Cr(¢ö)·ĻĖ®²¢ĢįČ”Cr2O3µÄŅ»ÖÖ¹¤ŅÕĮ÷³ĢČēĶ¼ĖłŹ¾”£
ŅŃÖŖ£ŗKsp[Cr(OH)3]£½6.3”Į10£31
Ksp[Fe(OH)3]£½2.6”Į10£39
Ksp[Fe(OH)2]£½4.9”Į10£17
£Ø1£©²½Öč¢ńÖŠ£¬·¢ÉśµÄ·“Ó¦ĪŖ2H£«£«2CrO42-![]() Cr2O72-£«H2O£¬BÖŠŗ¬øõŌŖĖŲµÄĄė×ÓÓŠ___(ĢīĄė×Ó·ūŗÅ)”£
Cr2O72-£«H2O£¬BÖŠŗ¬øõŌŖĖŲµÄĄė×ÓÓŠ___(ĢīĄė×Ó·ūŗÅ)”£
£Ø2£©µ±ĒåŅŗÖŠCr3£«µÄÅØ¶Č”Ü1.5mg”¤L£1Ź±£¬æÉČĻĪŖŅŃ“ļøõµÄÅŷűź×¼”£Čō²āµĆĒåŅŗµÄpH£½5£¬ŌņĒåŅŗÉŠ²»·ūŗĻøõµÄÅŷűź×¼£¬ŅņĪŖ“ĖŹ±Cr3£«µÄÅØ¶Č£½__mg”¤L£1”£
£Ø3£©²½Öč¢ņ»¹æÉÓĆĘäĖūĪļÖŹ“śĢęNaHSO3×÷»¹Ō¼Į”£
¢ŁČōÓĆFeSO4”¤7H2O×÷»¹Ō¼Į£¬²½Öč¢óÖŠ²Ī¼Ó·“Ó¦µÄŃōĄė×ÓŅ»¶ØÓŠ__(ĢīĄė×Ó·ūŗÅ)”£
¢ŚČōÓĆĢśŠ¼×÷»¹Ō¼Į£¬µ±ĢśµÄĶ¶·ÅĮæĻąĶ¬Ź±£¬¾¼ĘĖć£¬CČÜŅŗµÄpHÓėc(Cr2O72-)µÄ¶ŌÓ¦¹ŲĻµČēĻĀ±ķĖłŹ¾£ŗ
pH | 3 | 4 | 5 | 6 |
c(Cr2O72-)/mol”¤L£1 | 7.02”Į10£21 | 7.02”Į10£7 | 1.25”Į10£3 | 2.21”Į10£34 |
ÓŠČĖČĻĪŖpH£½6Ź±£¬c(Cr2O72-)±äŠ”µÄŌŅņŹĒCr2O72-»ł±¾ÉĻ¶¼ŅŃ×Ŗ»ÆĪŖCr3£«”£ÕāÖÖĖµ·ØŹĒ·ńÕżČ·£¬ĪŖŹ²Ć“£æ___”£
¢ŪÓĆĢśŠ¼×÷»¹Ō¼ĮŹ±£¬ĪŖŹ¹ĖłµĆ²śĘ·ÖŠŗ¬ĢśŌŖĖŲŌÓÖŹµÄŗ¬Įæ¾”æÉÄܵĶ£¬ŠčŅŖæŲÖʵÄĢõ¼žÓŠ___”£
”¾“š°ø”æCrO42-”¢Cr2O72- 32.76 Cr3£«”¢Fe3£«”¢H£« ²»ÕżČ·£¬c(H£«)¼õŠ”£¬»ÆŃ§Ę½ŗā2H£«£«2CrO42-![]() Cr2O72-£«H2OĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬ČÜŅŗÖŠCr(¢ö)Ö÷ŅŖŅŌCrO42-ŠĪŹ½“ęŌŚ ĢśŠ¼¹żĮ棻½«ČÜŅŗµÄpHæŲÖĘŌŚŹ¹Cr3£«ĶźČ«³Įµķ¶ųFe2£«²»³ĮµķµÄ·¶Ī§ÄŚ
Cr2O72-£«H2OĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬ČÜŅŗÖŠCr(¢ö)Ö÷ŅŖŅŌCrO42-ŠĪŹ½“ęŌŚ ĢśŠ¼¹żĮ棻½«ČÜŅŗµÄpHæŲÖĘŌŚŹ¹Cr3£«ĶźČ«³Įµķ¶ųFe2£«²»³ĮµķµÄ·¶Ī§ÄŚ
”¾½āĪö”æ
øł¾Ż»ÆŃ§Ę½ŗāדĢ¬µÄĢŲÕ÷½ųŠŠ·ÖĪö£¬øł¾ŻČܶȻżµÄ±ķ“ļŹ½½ųŠŠĻą¹Ų¼ĘĖćŗĶÅŠ¶Ļ”£
(1)²½Öč¢ńÖŠ£¬·¢ÉśµÄ·“Ó¦ĪŖ2H£«£«2CrO42-![]() Cr2O72-£«H2O£¬Ņņ“Ė£¬BÖŠŗ¬øõŌŖĖŲµÄĄė×ÓÓŠCrO42-”¢Cr2O72-”£
Cr2O72-£«H2O£¬Ņņ“Ė£¬BÖŠŗ¬øõŌŖĖŲµÄĄė×ÓÓŠCrO42-”¢Cr2O72-”£
(2)ĒåŅŗµÄpH£½5£¬Ōņc(OH£)£½10£9 mol”¤L£1£¬c(Cr3£«)£½![]() mol”¤L£1£½6.3”Į10£4 mol”¤L£1£¬ŌņÖŹĮæÅضČĪŖ6.3”Į10£4 mol”¤L£1”Į52”Į103 mg”¤mol£1£½32.76 mg”¤L£1£¾1.5mg”¤L£1£¬Ņņ“Ė£¬ĒåŅŗÉŠ²»·ūŗĻøõµÄÅŷűź×¼”£
mol”¤L£1£½6.3”Į10£4 mol”¤L£1£¬ŌņÖŹĮæÅضČĪŖ6.3”Į10£4 mol”¤L£1”Į52”Į103 mg”¤mol£1£½32.76 mg”¤L£1£¾1.5mg”¤L£1£¬Ņņ“Ė£¬ĒåŅŗÉŠ²»·ūŗĻøõµÄÅŷűź×¼”£
(3)¢ŁČōÓĆFeSO4”¤7H2O×÷»¹Ō¼Į£¬ŌņŃĒĢśĄė×Ó½«±»Ńõ»ÆĪŖĢśĄė×Ó£¬¹ŹCÖŠµÄŃōĄė×ÓÓŠFe2£«”¢Fe3£«”¢Cr3£«”¢H£«£¬ÓÉÓŚKsp[Fe(OH)2]½Ļ“󣬲½Öč¢óÖŠ²Ī¼Ó·“Ó¦µÄŃōĄė×ÓŅ»¶ØÓŠFe3£«”¢Cr3£«”¢H£«”£
¢ŚÕāÖÖĖµ·Ø²»ÕżČ·£¬ŅņĪŖc(H£«)¼õŠ”£¬»ÆŃ§Ę½ŗā2H£«£«2CrO42-![]() Cr2O72-£«H2OĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬ČÜŅŗÖŠCr(¢ö)Ö÷ŅŖŅŌCrO42-ŠĪŹ½“ęŌŚ”£
Cr2O72-£«H2OĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬ČÜŅŗÖŠCr(¢ö)Ö÷ŅŖŅŌCrO42-ŠĪŹ½“ęŌŚ”£
¢ŪÓĆĢśŠ¼×÷»¹Ō¼ĮŹ±£¬ĪŖŹ¹ĖłµĆ²śĘ·ÖŠŗ¬ĢśŌŖĖŲŌÓÖŹµÄŗ¬Įæ¾”æÉÄܵĶ£¬øł¾ŻKsp[Cr(OH)3]£½6.3”Į10£31”¢Ksp[Fe(OH)2]£½4.9”Į10£17æÉÖŖ£¬ŠčŅŖæŲÖʵÄĢõ¼žÓŠ£ŗĢśŠ¼¹żĮ棬²¢ĒŅ½«ČÜŅŗµÄpHæŲÖĘŌŚŹ¹Cr3£«ĶźČ«³Įµķ¶ųFe2£«²»³ĮµķµÄ·¶Ī§ÄŚ”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ(Ņ»)ŅŃÖŖĆŗĘų»ÆÖĘŗĻ³ÉĘų(CO ŗĶH2)µÄÖ÷ŅŖ·“Ó¦ÓŠ£ŗ
¢ŁC(s)+H2O(g)CO(g)+H2(g)”÷H1£½131.3kJmol©1
¢ŚC(s)+2H2O(g)CO2(g)+2H2(g)”÷H2£½90kJmol©1
(1)ÓŠĄūÓŚĢįøßÉĻŹö·“Ó¦¢ŁĘ½ŗā×Ŗ»ÆĀŹµÄĢõ¼žŹĒ_____”£
A.øßĪĀøßŃ¹B.øßĪĀµĶŃ¹C.µĶĪĀøßŃ¹D.µĶĪĀµĶŃ¹
(2)ŃŠ¾æ±ķĆ÷£¬½«C(s)ŗĶH2O(g)ÖĆÓŚĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦¢Ł£¬ÉżøßĪĀ¶Č£¬Ōö“óŃ¹Ē棬ĒāĘųµÄŗ¬ĮæŅ²ĻŌÖųŌö“ó£¬ĄķÓÉŹĒ_____”£
(3)ÓÉŗĻ³ÉĘųÖĘ¼×“¼ÄÜ·¢Éś·“Ó¦£ŗCO(g)+2H2(g)CH3OH(g)”÷H£¼0£¬ŌŚĻąĶ¬ČŻ»żµÄ ¼×”¢ŅŅ”¢±ūČżøöŗćČŻĆܱÕČŻĘ÷ÖŠ·Ö±šĶ¶ČėamolCOŗĶ2amolH2£¬ČżøöČŻĘ÷µÄ·“Ó¦ĪĀ¶Č·Ö±šĪŖ T1”¢T2”¢T3ĒŅŗć¶Ø²»±ä£¬ŌŚĘäĖūĢõ¼žĻąĶ¬µÄĒéæöĻĀ£¬ŹµŃé²āµĆ·“Ó¦¾ł½ųŠŠµ½tminŹ±CO µÄĢå»ż·ÖŹżČēĶ¼ĖłŹ¾”£
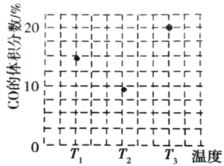
¢ŁČżøöČŻĘ÷ÖŠŅ»¶Ø“¦ÓŚ»ÆŃ§Ę½ŗāדĢ¬µÄŹĒ_____(Ģī”°¼×”±”°ŅŅ”±»ņ”°±ū”±)£»øĆČŻĘ÷ÖŠCH3OH(g)µÄĢå»ż·ÖŹżĪŖ_____”£
¢ŚŌŚĶ¼ÖŠ·Ö±š»³ö·“Ó¦CO(g)+2H2(g)CH3OH(g)”÷H£¼0ŌŚĪŽ“߻ƼĮ”¢ÓŠ“߻ƼĮĮ½ ÖÖĒéæöĻĀ”°·“Ó¦¹ż³Ģ-ÄÜĮæ”±Ź¾ŅāĶ¼_____”£

(¶ž)ŌĖÓƵē½ā·Ø£¬ŌŚĖįŠŌĢõ¼žĻĀæÉŅŌ½«CO2×Ŗ»ÆĪŖC3H8O£¬Š“³öµē½āÉś³ÉC3H8OµÄµē¼«·“Ó¦Ź½_____”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶ĢÖÜĘŚŌ×ÓŠņŹżŅĄ“ĪµŻŌöµÄ A”¢B”¢C”¢D”¢E”¢F ĮłÖÖŌŖĖŲ£¬ŅŃÖŖB Ō×Ó×īĶā²ćµē×ÓŹżŹĒA Ō×Ó“ĪĶā²ćµē×ÓŹżµÄ 3 ±¶£¬ŹĒ D Ō×Ó×īĶā²ćµē×ÓŹżµÄ 2 ±¶£»C Ō×ÓÄŚ²ćµē×Ó×ÜŹżŹĒ×īĶā²ćµē×ÓŹż 10 ±¶£»A”¢B”¢D ČżÖÖŌŖĖŲµÄŌ×Ó×īĶā²ćµē×ÓŹżÖ®ŗĶĪŖ 13£» A ŗĶB Ō×Ó×īĶā²ćµē×ÓŹżÖ®ŗĶÓėD ŗĶ F Ō×Ó×īĶā²ćµē×ÓŹżÖ®ŗĶĻąµČ£» E ŗĶ F ŹĒĻąĮŚŌŖĖŲ”£»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©E ŌŖĖŲµÄĆū³ĘĪŖ__£»ĘäŌŚŌŖĖŲÖÜĘŚ±ķÖŠµÄĪ»ÖĆŹĒ__”£
£Ø2£©AB2 µÄµē×ÓŹ½ĪŖ__£»ÓƵē×ÓŹ½±ķŹ¾E µÄĒā»ÆĪļµÄŠĪ³É¹ż³Ģ__”£
£Ø3£©C ŗĶ F ŌŖĖŲµÄ×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ__£»
£Ø4£©B”¢C”¢D”¢F ĖÄÖÖŌŖĖŲŌ×Ó°ė¾¶Óɓ󵽊”µÄĖ³ŠņŹĒ__£ØĢīŌŖĖŲ·ūŗÅ£©£¬Ąė×Ó°ė¾¶×īŠ”µÄŹĒ__£ØĢīĄė×Ó·ūŗÅ£©”£
£Ø5£©B ŗĶ E µÄ¼ņµ„Ēā»ÆĪļÖŠ·Šµć½ĻøߵďĒ__£ØĢī»ÆѧŹ½£©£¬A ŗĶB µÄ¼ņµ„Ēā»ÆĪļÖŠĪČ¶ØŠŌ½ĻŗƵďĒ__£ØĢī»ÆѧŹ½£©”£
£Ø6£©¶ĢÖÜĘŚŌŖĖŲM Óė D ŌŖĖŲĪ»ÓŚ²»Ķ¬Ö÷×壬øł¾Ż¶Ō½ĒĻß¹ęŌņ¶žÕßijŠ©ŠŌÖŹĻąĖĘ”£½« M µÄ×īøß¼ŪŃõ»ÆĪļČÜÓŚ C µÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļČÜŅŗÖŠ£¬·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ__”£
£Ø7£©ÓÉ B”¢C Į½ÖÖŌŖĖŲ×é³ÉµÄ»ÆŗĻĪļÓŠĮ½ÖÖ£¬ĘäÖŠŅ»ÖÖĪŖµ»ĘÉ«£¬øĆĪļÖŹµÄµē×ÓŹ½ĪŖ__”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ·“Ó¦£ŗH2(g)£«![]() O2(g)=H2O(g) ¦¤H1
O2(g)=H2O(g) ¦¤H1
![]() N2(g)£«O2(g)=NO2(g) ¦¤H2
N2(g)£«O2(g)=NO2(g) ¦¤H2
![]() N2(g)£«3/2H2(g)=NH3(g) ¦¤H3
N2(g)£«3/2H2(g)=NH3(g) ¦¤H3
Ōņ·“Ó¦2NH3(g)£«![]() O2(g)=2NO2(g)£«3H2O(g)µÄ¦¤HĪŖ£Ø £©
O2(g)=2NO2(g)£«3H2O(g)µÄ¦¤HĪŖ£Ø £©
A. 2¦¤H1£«2¦¤H2£2¦¤H3B. ¦¤H1£«¦¤H2£¦¤H3
C. 3¦¤H1£«2¦¤H2£«2¦¤H3D. 3¦¤H1£«2¦¤H2£2¦¤H3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖX”¢Y”¢Z¶¼ŹĒ¶ĢÖÜĘŚµÄŌŖĖŲ£¬ĖüĆĒµÄŌ×ÓŠņŹżŅĄ“ĪµŻŌö£¬XŌ×ӵĵē×Ó²ćŹżÓėĖüµÄŗĖĶāµē×Ó×ÜŹżĻąĶ¬£¬¶ųZŌ×ÓµÄ×īĶā²ćµē×ÓŹżŹĒ“ĪĶā²ćµÄČż±¶£¬YŗĶZæÉŅŌŠĪ³ÉĮ½ÖÖŅŌÉĻĘųĢ¬»ÆŗĻĪļ£¬Ōņ£ŗ
(1)XŹĒ______£¬YŹĒ______£¬ZŹĒ______(ĢīŌŖĖŲ·ūŗÅ)
(2)ÓÉYŗĶZ×é³É£¬ĒŅYŗĶZµÄÖŹĮæ±ČĪŖ7”Ć20µÄ»ÆŗĻĪļµÄ»ÆѧŹ½(·Ö×ÓŹ½)ŹĒ______£®
(3)ÓÉX”¢Y”¢ZÖŠµÄĮ½ÖÖŌŖĖŲ×é³É£¬ĒŅÓė![]() ·Ö×Ó¾ßÓŠĻąĶ¬µē×ÓŹżµÄĮ½ÖÖĄė×ÓŹĒ______ŗĶ______
·Ö×Ó¾ßÓŠĻąĶ¬µē×ÓŹżµÄĮ½ÖÖĄė×ÓŹĒ______ŗĶ______
(4)X”¢Y”¢ZæÉŅŌŠĪ³ÉŅ»ÖÖŃĪ£¬“ĖŃĪÖŠX”¢Y”¢ZŌŖĖŲµÄŌ×ÓµÄøöŹż±ČĪŖ4”Ć2”Ć3£¬øĆŃĪµÄ»ÆѧŹ½(·Ö×ÓŹ½)ŹĒ______
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ£ŗTKŹ±£¬Ca(OH)2”¢CaWO4¶¼Ī¢ČÜÓŚĖ®”£pCa£½£lgc(Ca2£«)£¬pX£½£lgc(WO42-)»ņ£lgc(OH£)”£TKŹ±CaWO4”¢Ca(OH)2µÄ³ĮµķČܽāĘ½ŗāĒśĻßČēĶ¼ĖłŹ¾”£

£Ø1£©¢ŁĻņNa2WO4ČÜŅŗÖŠ¼ÓČė±„ŗĶŹÆ»ŅĖ®£¬ĻÖĻóĪŖ__£¬Ąė×Ó·½³ĢŹ½ĪŖ£ŗ__”£
¢ŚNa2WO4ČÜŅŗŗĶŹÆ»ŅČé»ģŗĻ£¬»į²śÉś“óĮæµÄCaWO4£¬ŌņøĆ·“Ó¦µÄĘ½ŗā³£ŹżK£½__”£
£Ø2£©ŅŃÖŖKsp(BaSO4)£½1.1”Į10£10£¬Ksp(BaMoO4)£½4.0”Į10£8£¬īāĖįÄĘ¾§Ģå(Na2MoO4”¤2H2O)ŹĒŠĀŠĶµÄ½šŹō»ŗŹ“¼Į£¬²»“æµÄīāĖįÄĘČÜŅŗÖŠČōŗ¬ÉŁĮææÉČÜŠŌĮņĖįŃĪŌÓÖŹ£¬æɼÓČėBa(OH)2¹ĢĢå³żČ„SO42-(ČÜŅŗĢå»ż±ä»ÆŗöĀŌ)£¬Ōņµ±BaMoO4æŖŹ¼³ĮµķŹ±£¬ČÜŅŗÖŠµÄ![]() £½__(½į¹ū±£Įō2Ī»ÓŠŠ§Źż×Ö)”£
£½__(½į¹ū±£Įō2Ī»ÓŠŠ§Źż×Ö)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄ³Ń§Ļ°Š”×éĪŖŃŠ¾æĶÓėÅØ”¢Ļ”HNO3·“Ó¦µÄ²īŅģ£¬Éč¼ĘĮĖČēĶ¼ĖłŹ¾µÄŹµŃé×°ÖĆ”£

ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
A. ·“Ó¦æŖŹ¼Ē°ĶØČė¹żĮæµÄCO2ĘųĢ壬ÄæµÄŹĒÅųż×°ÖĆÄŚµÄæÕĘų
B. AÖŠµÄĄė×Ó·½³ĢŹ½ĪŖ£ŗCu+2NO3-+4H+==Cu2++2NO2”ü+2H2O
C. µ±BÖŠ0.03 molĶ·Ū±»Ńõ»ÆŹ±£¬BÖŠ²śÉśµÄNOĘųĢå“óÓŚ0.02 mol
D. C×°ÖĆ֊װČėŅ»¶ØĮæµÄĖ®½ųŠŠĪ²Ęų“¦Ąķ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆNA±ķŹ¾°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ£¬ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ£Ø £©
A.±ź×¼×“æöĻĀ£¬22.4 LČżŃõ»ÆĮņÖŠŗ¬ÓŠµÄ·Ö×ÓŹżĪŖNA
B.0.5 mol”¤L-1µÄNa2SO4ČÜŅŗÖŠ£¬ŗ¬ÓŠNa£«µÄøöŹżĪŖNA
C.±ź×¼×“æöĻĀ£¬22.4L¶žŃõ»ÆĮņÓė22.4LŃõĘųĖłŗ¬µÄŌ×Ó×ÜŹż¾łĪŖ2NA
D.32 g ŃõĘųĖłŗ¬µÄŃõŌ×ÓŹżÄæĪŖ2NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijøɵē³ŲµÄ¹¤×÷ŌĄķČēĶ¼ĖłŹ¾£¬×Ü·“Ó¦ĪŖ£ŗ![]() £¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ

A.ŹÆÄ«ĪŖµē³ŲµÄøŗ¼«
B.µē³Ų¹¤×÷Ź±![]() ±»Ńõ»Æ
±»Ńõ»Æ
C.ŹµĻÖĮĖµēÄÜĻņ»ÆѧÄÜ×Ŗ»Æ
D.µē×ÓÓÉZnµē¼«¾ĶāµēĀ·Į÷ĻņŹÆÄ«µē¼«
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com