
| A. | 任何化学反应的限度都相同 | |
| B. | 可以通过改变温度控制化学反应的限度 | |
| C. | 可以通过延长化学反应的时间改变化学反应的限度 | |
| D. | 当一个化学反应在一定条件下达到最大限度时,反应速率也最大 |
分析 在一定条件下的可逆反应经过移动的时间后,正、逆反应速率相等,反应物和生成物的浓度不再发生变化,这种表面上静止的“平衡状态”就是这个可逆反应所能达到的限度,由此解答.
解答 解:在一定条件下的可逆反应经过移动的时间后,正、逆反应速率相等,反应物和生成物的浓度不再发生变化,这种表面上静止的“平衡状态”就是这个可逆反应所能达到的限度.
A、化学反应不同,限度不同,故A错误;
B、可以改变外界条件控制化学反应的限度,故B正确;
C、化学反应的限度与反应时间无关,故C错误;
D、当化学反应在一定条件下达到限度时,正、逆反应速率相等,反应未停止,故D错误.
故选B.
点评 本题考查化学反应限度,温度、浓度、气体的压强等都能使化学反应速率发生改变,所以化学反应的限度可用通过改变条件而改变.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
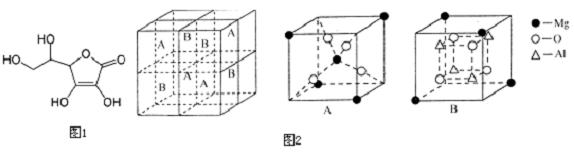
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②⑤ | C. | ②③⑤ | D. | ②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 72 | B. | 53 | C. | 19 | D. | 125 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
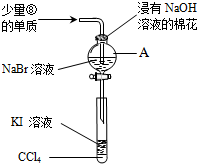 下表是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:
下表是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
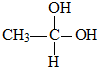 →CH3-CHO+H2O
→CH3-CHO+H2O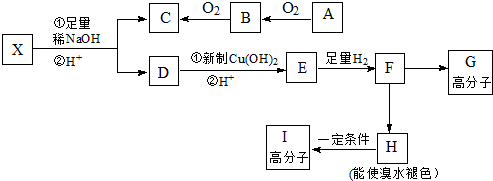
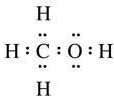 .
. ;
;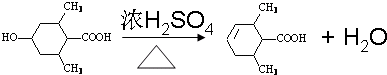 ;
;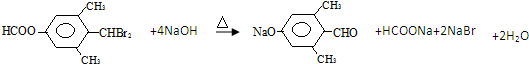 ;
;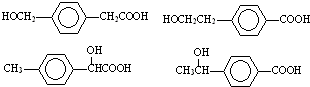 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
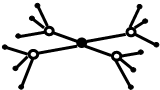 周期表前四周期的元素X、Y、Z、T、W,原子序数依次增大.X的核外电子总数与其周期数相同,Y基态原子的p电子数比s电子数少1个,Z基态原子的价电子层中有2个未成对电子,T与Z同主族,W基态原子的M层全充满,N层只有一个电子.回答下列问题:
周期表前四周期的元素X、Y、Z、T、W,原子序数依次增大.X的核外电子总数与其周期数相同,Y基态原子的p电子数比s电子数少1个,Z基态原子的价电子层中有2个未成对电子,T与Z同主族,W基态原子的M层全充满,N层只有一个电子.回答下列问题: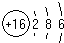 ,W基态原子的电子排布式为[Ar]3d104s1.
,W基态原子的电子排布式为[Ar]3d104s1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
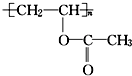 ,下列关于该有机物叙述不正确的是( )
,下列关于该有机物叙述不正确的是( )| A. | 1 mol 该有机物与 NaOH 溶液完全反应时,消耗 NaOH 1 mol | |
| B. | 该有机物水解所得产物能发生取代反应 | |
| C. | 该有机物可通过加聚反应生成 | |
| D. | 该有机物分子中含有双键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com