
| A. | 同温同压下,两份相同质量的铁粉,分别与足量的稀硫酸和稀硝酸反应,产生气体的体积相同 | |
| B. | 非金属氧化物不一定是酸性氧化物,金属氧化物多数是碱性氧化物 | |
| C. | 活性炭、SO2、Na2O2都能使品红溶液褪色,但原理不同 | |
| D. | 将CO2气体通入BaCl2溶液中至饱和未见沉淀生成,继续通入NO2则有沉淀生成 |
分析 A.足量的稀硫酸和稀硝酸反应,与Fe发生的反应不同,Fe~2HCl~H2↑、Fe~4HNO3~NO↑;
B.非金属氧化物分为酸性氧化物和不成盐氧化物,金属氧化物大部分属于碱性氧化物;
C.活性炭为吸附性,二氧化硫与品红化合,过氧化钠具有强氧化性;
D.CO2气体通入BaCl2溶液中,不反应,继续通入NO2,与二氧化碳不反应.
解答 解:A.足量的稀硫酸和稀硝酸反应,与Fe发生的反应不同,由Fe~2HCl~H2↑、Fe~4HNO3~NO↑可知,等量的Fe反应产生气体的体积相等,故A正确;
B.非金属氧化物分为酸性氧化物和不成盐氧化物,如CO为非金属氧化物,但不是酸性氧化物,金属氧化物大部分属于碱性氧化物,如氧化钠、氧化镁等,故B正确;
C.活性炭为吸附性,二氧化硫与品红化合,过氧化钠具有强氧化性,则能使品红溶液褪色,但原理不同,故C正确;
D.CO2气体通入BaCl2溶液中,不反应,继续通入NO2,与二氧化碳不反应,二氧化氮和水反应生成硝酸和一氧化氮,没有沉淀生成,故D错误.
故选D.
点评 本题考查物质的性质,为高频考点,综合考查元素化合物知识,把握漂白原理、发生的氧化还原反应及除杂的方法为解答的关键,选项A中发生的反应为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 酸的水溶液呈酸性,故酸性水溶液一定是酸的水溶液 | |
| B. | Fe3O4可写成FeO?Fe2O3;Pb3O4也可写成PbO?Pb2O3 | |
| C. | 工业上通过电解熔融MgCl2来制取金属镁;也可以通过电解熔融AlCl3来制取金属铝 | |
| D. | 第2周期元素氢化物稳定性顺序是HF>H2O>NH3;则第3周期元素氢化物稳定性顺序是HCl>H2S>PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
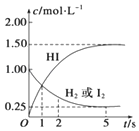 698K时,向某V L的密闭容器中充入3mol H2(g)和3mol I2(g),发生反应:H2(g)+I2(g)?2HI(g),测得各物质的物质的量浓度与时间变化的关系如右图所示.请回答下列问题:
698K时,向某V L的密闭容器中充入3mol H2(g)和3mol I2(g),发生反应:H2(g)+I2(g)?2HI(g),测得各物质的物质的量浓度与时间变化的关系如右图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
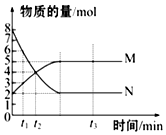 一定温度下,在容积为VL的密闭容器里进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为VL的密闭容器里进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
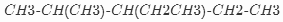 的名称是2-甲基-3-乙基戊烷.
的名称是2-甲基-3-乙基戊烷. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
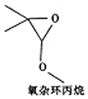
| A. | 该有机物的分子式为C5H9O2 | |
| B. | 该有机物能与金属钠反应 | |
| C. | 该有机物的同分异构体(不考虑立休异构)中,能水解生成羧酸与醇的物质共有9种 | |
| D. | 该有机物的同分异构体(不考虑立体异构)中,属于羧酸的物质共有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将2.4g炭完全转化为水煤气,然后再充分燃烧,整个过程放出热量39.35kJ | |
| B. | C的燃烧热为-110.5kJ/mol | |
| C. | H2的燃烧热为-241.8kJ/mol | |
| D. | 由反应③可知,反应过程中转移5mol电子且生成液态水时放出的热量大于604.5kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:
运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结 论 |
| A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO42- |
| B | 2mL10%的CuSO4溶液中滴加2%的NaOH溶液4~6滴制得新制氢氧化铜,再滴加几滴葡萄糖溶液,加热 | 检验葡萄糖中含有醛基 |
| C | 向1mL浓度均为0.05mol•L-l NaCl、NaI的混合溶液中滴加2滴0.01mol•L-lAgNO3溶液,振荡,沉淀呈黄色 | Ksp (AgCl)<Ksp(AgI) |
| D | 将Al2(SO4)3溶液蒸干、灼烧至恒重 | 最终剩余固体是Al2O3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com