

 ���ʴ�Ϊ��̼̼˫����ȩ����
���ʴ�Ϊ��̼̼˫����ȩ���� ��
��| �� |
| �� |
| Ũ���� |
| �� |
 +2H2O��
+2H2O��| Ũ���� |
| �� |
 +2H2O��
+2H2O��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����ʵ���Ũ��Ϊ0.5mol/L��MgCl2��Һ�У�����Cl-����Ϊ1NA |
| B����״���£�11.2L H2O�����ķ�����Ϊ0.5NA |
| C�����³�ѹ�£�1.06g Na2CO3���е�Na+������Ϊ0.02NA |
| D��18g H2O��H2O2�Ļ���ﺬ�еķ�����Ϊ1NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��NaHCO3��Һ�е�ˮ�⣺HCO3-+H2O?H3O++CO32- |
| B���Ȼ�����Һ��ͨ�����⣺2Fe3++H2S=2Fe2++S��+2H+ |
| C��CaCl2��Һ��ͨ��CO2��Ca2++CO2+H2D=CaCO3��+2H+ |
| D��NaHSO4��Һ����μ���Ba��OH��2��Һ��ǡ�ó����ԣ�Ba2++OH-+H-+SO42-=BaSO4��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ڢۢܢ� | B���ڢ٢ۢ� |
| C���ۢڢܢ� | D���ۢڢ٢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���ᴿ������ | ѡ�õ��Լ� | ��Ӧ���ӷ���ʽ |
| ��1��Mg ��Al�� | ||
| ��2��FeCl3��FeCl2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��BaCl2 �ͣ�NH4��2C03 |
| B��AgNO3 �� NH4Cl |
| C��FeCl3�� NaHCO3 |
| D��KCl �� Na2CO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
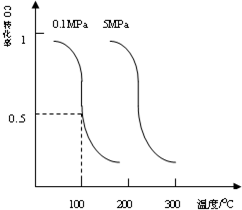 �о��Ϳ���CO2��CO�Ĵ��������ǻ�����������Դ���õ�˫Ӯ�Ŀ��⣮
�о��Ϳ���CO2��CO�Ĵ��������ǻ�����������Դ���õ�˫Ӯ�Ŀ��⣮| 1 |
| 2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com