
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A、T、Q的氢化物常态下均为无色气体 |
| B、L、M的单质与稀盐酸反应速率:M>L |
| C、R的氧化物对应的水化物可能具有两性 |
| D、L、Q形成的简单离子核外电子数相等 |


科目:高中化学 来源: 题型:
| A、35Cl原子所含质子数为18 | ||
B、
| ||
| C、3.5g35Cl2气体的体积为1.12L | ||
| D、已知自然界中氯元素的平均相对原子质量为35.5,则37Cl的质量分数为25% |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知25℃时有关弱酸的电离平衡常数:
已知25℃时有关弱酸的电离平衡常数:| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 除去悬浮 |
| 杂质 |
| 浓缩 |
| 氧化剂 |
| 氧化 |
| 热空气 |
| Na2CO3溶液 |
| 吸收 |
| H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
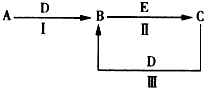
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滤出的不溶物一定是铜 |
| B、滤出的不溶物一定含铜,但不一定含铁 |
| C、滤出的不溶物一定是铁 |
| D、滤液中一定含有Fe2+和Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

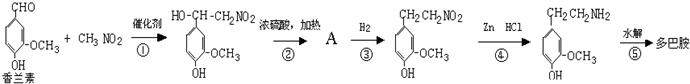 (3)多巴胺可由香兰素与硝基甲烷缩合,再经锌-盐酸还原水解而得.合成过程表示如下:
(3)多巴胺可由香兰素与硝基甲烷缩合,再经锌-盐酸还原水解而得.合成过程表示如下:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com