
【题目】己知图甲表示某温度下pH=l的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,图乙表示水在不同温度下的电离平衡曲线。下列有关图像的判断叙述正确的是
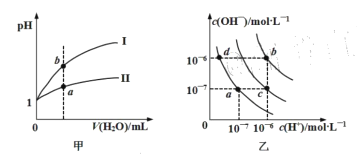
A.图甲中曲线II为盐酸
B.图甲中a点溶液的导电性比b点弱
C.图乙中纯水仅升高温度,就可以从a点变到c点
D.图乙中在b点对应温度下,将pH=2的H2SO4溶液与pH=10的NaOH溶液等体积混合后,溶液显中性
【答案】D
【解析】
A.相同pH的盐酸和醋酸溶液分别加水稀释相同倍数时,盐酸的pH变化大,醋酸为弱酸稀释促进电离,加水稀释后醋酸pH较小,曲线II为醋酸,故A错误;
B.溶液导电性与溶液中离子浓度成正比,b点pH大于a点,b点c(H+)小于a点,b点溶液的导电性比a点弱,故B错误;
C.纯水仅升高温度,促进水解,氢离子和氢氧根离子浓度均增大,图乙中从a点变到c点氢氧根离子浓度不变,故C错误;
D.图乙中在b点对应的温度下,Kw=10-12,中性溶液pH=6;将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,c(H+)=10-2mol/L,c(OH-)=10-2mol/L浓度相同,等体积混合溶液呈中性,所以D选项是正确的。
答案选D。


科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p轨道的电子数等于次外层的电子总数,B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7∶8,E与B的质量比为1∶1。根据以上条件,回答下列问题:
(1)画出C的原子结构示意图:________。
(2)写出D原子的外围电子排布式:________。
(3)写出A元素单质在B中完全燃烧的化学方程式:______________。
(4)指出E元素在元素周期表中的位置:____________。
(5)比较A、B、C三种元素的第一电离能的大小顺序:________________(按由大到小的顺序排列,用元素符号表示)。
(6)比较元素D和E的电负性的相对大小:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由短周期前10号元素组成的物质T和X,如图所示的转化。X不稳定,易分解。为使得下列转化能够成功进行,方框内不可能加入的反应试剂是 ( )
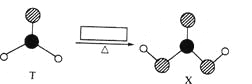
A.Ag(NH3)2OHB.溴水
C.酸性KMnO4溶液D.NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A.c(H+)/c(OH-)=1×10-12的溶液中:![]()
B.0.1mol/LHCl溶液:![]()
C.0.1mol/LK2CO3溶液:![]()
D.c(Fe2+)=0.1mol/L溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列叙述不能作为可逆反应A(g)+3B(g)![]() 2C(g)达到平衡标志的是
2C(g)达到平衡标志的是
①C的生成速率与C的消耗速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④C的物质的量不再变化
⑤混合气体的总压强不再变化
⑥混合气体的总物质的量不再变化
⑦单位时间消耗a molA,同时生成3a mol B
⑧A、B、C的分子数之比为1:3:2
A. ⑤⑥B. ⑦④C. ①③D. ②⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
(1)当反应达到平衡时,N2和H2的浓度比是________;N2和H2的转化率比是________。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量__________,密度__________。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将________(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO3-+5SO32-+2H+=I2+5SO42-+H2O,生成的I2可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
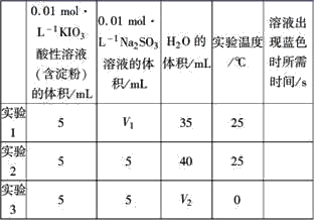
该实验的目的是_________;表中V2=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C中均含有10个电子。它们之间转化关系如图所示。下列说法正确的是( )
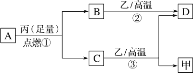
A.原子半径:Z>Y>X
B.X与Y形成的化合物只含共价键,能形成原子晶体
C.Y有多种同素异形体,且均具有高熔点、高沸点、硬度大的性质
D.气态氢化物的稳定性:A<C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的回收与利用是科学家研究的热点课题,可利用CH4与CO2制备“合成气”(CO、H2),还可制备甲醇、二甲醚、低碳烯烃等燃料产品。
I.制合成气
科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g)![]() C(ads)+2H2 (g) (慢反应)
C(ads)+2H2 (g) (慢反应)
反应②:C(ads)+ CO2(g)![]() 2CO(g) (快反应)
2CO(g) (快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:

(1)CH4与CO2制备“合成气”的热化学方程式为_________。能量变化图中:E5+E1_________E4+E2(填“>”、“<”或“=”)。
II.脱水制醚
利用“合成气”合成甲醇后,甲醇脱水制得二甲醚的反应为:
2CH3OH(g)![]() CH3OCH3(g) + H2O(g) ΔH,其速率方程式为:v正= k正·c2(CH3OH),v逆=k逆·c(CH3OCH3)·c(H2O),k正、k逆为速率常数且只与温度有关。经查阅资料,上述反应平衡状态下存在计算式:lnKc = 2.205+
CH3OCH3(g) + H2O(g) ΔH,其速率方程式为:v正= k正·c2(CH3OH),v逆=k逆·c(CH3OCH3)·c(H2O),k正、k逆为速率常数且只与温度有关。经查阅资料,上述反应平衡状态下存在计算式:lnKc = 2.205+![]() (Kc为化学平衡常数;T 为热力学温度,单位为K)。
(Kc为化学平衡常数;T 为热力学温度,单位为K)。
(2)反应达到平衡后,仅升高温度,k正增大的倍数_________ k逆增大的倍数(填“>”、“<”或“=”)。
(3)某温度下(该反应平衡常数Kc为200),在密闭容器中加入一定量 CH3OH,反应到某时刻测得各组分的物质的量如下:
物质 | CH3OH | CH3OCH3 | H2O |
物质的量/mol | 0.4 | 0.4 | 0.4 |
此时正、逆反应速率的大小:v正 ____v逆 (填“>”、 “<”或“=”)。
(4)500K下,在密闭容器中加入一定量甲醇 CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为_________(填标号)。
A <![]() B
B ![]() C >
C >![]() D 无法确定
D 无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com