
【题目】下图是元素周期表的一部分,元素①~⑨在周期表中的位置如图所示,请回答下列问题:
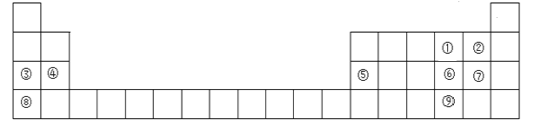
(1)元素⑨在周期表中的位置是_______。
(2)元素①~⑨中,非金属性最强的元素是_______(填元素符号)。
(3)元素①~⑨中,最高价氧化物对应的水化物中,碱性最强的是_______(填化学式),它与元素⑤的最高价氧化物对应水化物反应的离子方程式为_______。
(4)元素⑨的简单氢化物与元素⑦的简单氢化物中更稳定的是_______(填化学式)。
(5)元素③与元素①形成的淡黄色化合物的电子式为_______。
(6)元素①的简单氢化物比元素⑥的简单氢化物的沸点_______(填“高”或“低”),原因是_______。
(7)元素④与元素⑦形成的化合物是_______(填“离子”或“共价”)化合物,用电子式表示其形成过程_______。
【答案】第四周期第VIA族 F KOH OH- + Al(OH)3= AlO2- +2H2O HCl ![]() 高 水分子间存在氢键 离子
高 水分子间存在氢键 离子 ![]()
【解析】
由图中元素所在位置,并与元素周期表进行对照,可确定①为氧(O)、②为氟(F)、③为钠(Na)、④为镁(Mg)、⑤为铝(Al)、⑥为硫(S)、⑦为氯(Cl)、⑧为钾(K)、⑨为硒(Se)。
(1)元素⑨为硒(Se),它是34号元素,在周期表中的位置是第四周期第VIA族。答案为:第四周期第VIA族;
(2)同周期元素,从左往右,非金属性依次增强;同主族元素,从下到上,非金属性依次增强,所以非金属性最强的元素位于周期表的左上角(稀有气体除外),从而得出元素①~⑨中,非金属性最强的元素是F。答案为:F;
(3)元素①~⑨中,金属性最强的元素是钾,所以最高价氧化物对应的水化物中,碱性最强的是KOH,KOH与Al(OH)3反应生成KAlO2和水,反应的离子方程式为OH- + Al(OH)3= AlO2- +2H2O。答案为:KOH;OH- + Al(OH)3= AlO2- +2H2O;
(4)非金属性Cl>Se,氢化物的稳定性H2Se<HCl,所以更稳定的是HCl。答案为:HCl;
(5)元素③与元素①形成的淡黄色化合物为Na2O2,电子式为![]() 。答案为:
。答案为:![]() ;
;
(6)元素①的简单氢化物为H2O,元素⑥的简单氢化物为H2S,由于H2O分子间能形成氢键,而H2S分子间不能形成氢键,所以水的沸点高,原因是水分子间存在氢键。答案为:高;水分子间存在氢键;
(7)元素④与元素⑦形成的化合物是MgCl2,由Mg2+和Cl-构成,是离子化合物,电子式表示其形成过程为![]() 。答案为:水分子间存在氢键;
。答案为:水分子间存在氢键;![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】有KOH和Ca(OH)2的混合溶液,pH=13。取此溶液500mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示。图中(V1)为112mL(标准状况),则图中V2、V3的体积(单位为mL)分别是

A. 560、672B. 1008、1120
C. 2240、2352D. 392、504
查看答案和解析>>
科目:高中化学 来源: 题型:
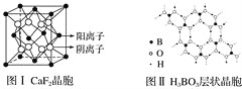
【题目】下图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:
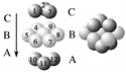
图Ⅲ 铜晶体中铜原子堆积模型
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________________,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为__________________________________。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________,H3BO3晶体中B原子个数与极性键个数比为____________。
(3)金属铜具有很好的延展性、导电性、传热性,对此现象最简单的解释是用________理论。
(4)三种晶体中熔点最低的是________(填化学式),其晶体受热熔化时,克服的微粒之间的相互作用为____________________________________________________________。
(5)已知两个距离最近的Ca2+核间距离为a×10-8cm,结合CaF2晶体的晶胞示意图,CaF2晶体的密度为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)为了验证 Fe2+与 Cu2+氧化性强弱,下列装置能达到实验目的的是_______(填装置序号), 其正极的电极反应式为_______;若构建该原电池时两个电极的质量相等,当导线中通过 0.4 mol 电子时,两个电极的质量差为_______g。

(2)将 CH4 设计成燃料电池,其利用率更高,装置如图所示(A、B 为多孔碳棒)。

实验测得 OH- 定向移向 A 电极,则_______(填 A 或 B)处电极入口通 CH4,其电极反应式为_______。
(3)金属冶炼和处理常涉及氧化还原反应。由下列物质冶炼相应金属时采用电解法的是_______(填选 项字母)。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年,节能减排、提高原料利用率来提高经济效益成为人们关注的焦点。某化工厂利用甲烷与氯气反应得到的副产品来制取盐酸实现了变废为宝的梦想,其生产原理可在实验室中模拟如图,请根据要求填空:

(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③__________。
(2)设![]() =x,若理论上欲获得最多的氯化氢,则x值应_________。
=x,若理论上欲获得最多的氯化氢,则x值应_________。
(3)在C装置中,经过一段时间的强光照射后,发现硬质玻璃管内壁附着有油珠,生成的油状液滴中的氯仿可作局部麻醉剂,常因保存不慎而被空气氧化,产生剧毒气体——光气,反应化学方程式为2CHCl3+O2![]() 2COCl2+2HCl,上述反应__________ (填选项符号,下同)。
2COCl2+2HCl,上述反应__________ (填选项符号,下同)。
A.属于取代反应 B.不属于取代反应
为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是____________。
A.氢氧化钠溶液 B.硝酸银溶液
C.稀盐酸 D.水
E.湿润的蓝色石蕊试纸 F.湿润的无色酚酞试纸
(4)D装置的石棉中均匀混有KI粉末,其作用是___________。
(5)E装置的作用是____________ (填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(6)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为_____________;该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为_____ (填编号)。
①CH4 ②CH3Cl ③CH2Cl2 ④CHCl3 ⑤CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是( )
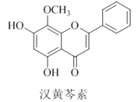
A. 汉黄芩素的分子式为C16H13O5
B. 该物质遇FeCl3溶液显色
C. 1 mol该物质与溴水反应,最多消耗1 mol Br2
D. 与足量H2发生加成反应,最多消耗H2 6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.0.1mol·L-1Na2CO3溶液中Na+的数目为0.2NA
B.标准状况下,2.24LCCl4中的分子数目为0.1NA
C.常温常压下,17g氨气中所含氢原子数目为3NA
D.3.2g由O2和O3组成的混合物含有分子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学实验操作、现象和结论均正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 向 | 溶液呈黄色 | NaHCO3溶液溶液呈碱性 |
B | 向氨水和 | 得到红褐色悬浊液 | Ksp[Fe(OH)3]<Ksp[Mg(OH)2] |
C | 使石蜡油蒸汽通过炽热的碎瓷片,再将产生的气体通过酸性KMnO4溶液 | KMnO4溶液褪色 | 石蜡油蒸汽中含有烯烃 |
D | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多孔的海绵状炭,放出有刺激性气味的气体 | 浓硫酸具有脱水性和强氧化性 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com