
| A. | $\frac{z}{12m}$ | B. | $\frac{12z}{m}$ | C. | $\frac{{N}_{A}}{m}$ | D. | $\frac{{N}_{A}}{z}$ |
分析 相对原子质量=$\frac{1gR原子的质量}{C-12原子质量的\frac{1}{12}}$或数值上与NA个R原子的质量的数值相同,据此可计算出R的相对原子质量.
解答 解:一个12C原子的质量为mg,一个R原子的质量为zg,则R原子相对原子质量=$\frac{zg}{mg×\frac{1}{12}}$=$\frac{12z}{m}$,
若阿伏加德罗常数的值为NA,则R的摩尔质量为mNAg/mol,故其相对原子质量为mNA,
故选B.
点评 本题考查物质的量的计算,为高频考点,把握相对原子质量的计算方法及与阿伏伽德罗常数的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | A | B | C |
| 装置 | 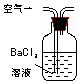 | 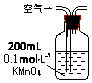 | 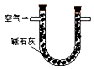 |
| 原理 | 通入V升空气,测定生成沉淀的质量 | 当KMnO4溶液刚好褪色时,测定通入空气的体积V | 通入V升空气,测定U型管增加的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
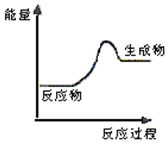
| A. | 该反应可能为吸热反应 | |
| B. | 该反应一定有能量转化成了生成物的化学能 | |
| C. | 反应物比生成物稳定 | |
| D. | 生成物的总能量高于反应物的总能量,反应不需要加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n(CO2)/mol | 0 | 1 | 3 | 1 |
| n(H2)/mol | 0 | 2 | 2 | 1 |
| n(CO)/mol | 3 | 0.5 | 1 | 2 |
| n(H2O)/mol | 3 | 2 | 5 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定条件下,反应2NH3(g)?N2(g)+3H2(g)达到平衡时N2的体积分数与温度、压强的关系如图所示.下列说法正确的是( )
一定条件下,反应2NH3(g)?N2(g)+3H2(g)达到平衡时N2的体积分数与温度、压强的关系如图所示.下列说法正确的是( )| A. | 压强:p1>p2 | B. | b、c两点对应的平衡常数:Kc>Kb | ||
| C. | a点:2v(NH3)正═3v(H2)逆 | D. | a点:NH3的转化率为$\frac{1}{3}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com