

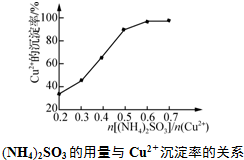
 ,工业上$\frac{n[(N{H}_{4})_{2}S{O}_{3}]}{n(C{u}^{2+})}$采用0.6最为适宜,此时(NH4)2SO3略过量,其原因是保证生成的CuCl不被氧气氧化或(NH4)2SO3被空气中的氧气氧化.
,工业上$\frac{n[(N{H}_{4})_{2}S{O}_{3}]}{n(C{u}^{2+})}$采用0.6最为适宜,此时(NH4)2SO3略过量,其原因是保证生成的CuCl不被氧气氧化或(NH4)2SO3被空气中的氧气氧化. 分析 海绵铜加入硫酸和硝酸铵溶解得到溶液主要是硫酸铜,硫酸铵等,加入亚硫酸铵还原硫酸铜加入氯化铵氯化发生反应2CuSO4+(NH4)2SO3+2NH4Cl+H2O=2CuCl↓+2(NH4)2SO4+H2SO4,过滤得到固体为CuCl,滤液主要是硫酸铵和硫酸,以此来解答.
解答 解:海绵铜加入硫酸和硝酸铵溶解得到溶液主要是硫酸铜,硫酸铵等,加入亚硫酸铵还原硫酸铜加入氯化铵氯化发生反应2CuSO4+(NH4)2SO3+2NH4Cl+H2O=2CuCl↓+2(NH4)2SO4+H2SO4,过滤得到固体为CuCl,滤液主要是硫酸铵和硫酸,
(1)溶解步骤的温度应控制在60~70℃,原因是温度低溶解速率慢,温度过高NH4NO3易分解;该步骤中Cu与NH4NO3反应的离子方程式为4Cu+NO3-+10H+═4Cu2++NH4++3H2O,故答案为:温度低溶解速率慢,温度过高NH4NO3易分解;4Cu+NO3-+10H+═4Cu2++NH4++3H2O;
(2)还原步骤发生反应的离子方程式为2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+,故答案为:2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+;
(3)由上述分析可知,滤液的主要成分为(NH4)2SO4、H2SO4,洗净过滤所得固体应选用硫酸,不引入新杂质,故答案为:(NH4)2SO4、H2SO4;B;
(4)工业上$\frac{n[(N{H}_{4})_{2}S{O}_{3}]}{n(C{u}^{2+})}$采用0.6最为适宜,此时(NH4)2SO3略过量,其原因是保证生成的CuCl不被氧气氧化或(NH4)2SO3被空气中的氧气氧化,
故答案为:保证生成的CuCl不被氧气氧化或(NH4)2SO3被空气中的氧气氧化.
点评 本题考查混合物分离提纯,为高频考点,把握流程中的反应、物质的性质、离子反应的书写等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
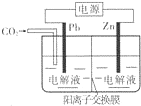 采用电化学法还原CO2是一种使CO2资源化的方法,下图是利用此法制备ZnC2O4的示意图(电解液不参与反应).下列说法正确的是( )
采用电化学法还原CO2是一种使CO2资源化的方法,下图是利用此法制备ZnC2O4的示意图(电解液不参与反应).下列说法正确的是( )| A. | Zn与电源的负极相连 | |
| B. | ZnC2O4在交换膜右侧生成 | |
| C. | 电解的总反应为:2C02+Zn$\frac{\underline{\;电解\;}}{\;}$ZnC2O4 | |
| D. | 通入11.2 L CO2时,转移0.5 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为7、中子数为8的氮原子:${\;}_{7}^{8}$N | |
| B. | 氮原子的结构示意图: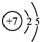 | |
| C. | 氨分子的电子式: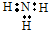 | |
| D. | 对硝基甲苯的结构简式:NO2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用强碱溶液吸收硝酸工业的尾气:NO+NO2+2OH-═2NO2-+H2O | |
| B. | NH4HCO3溶液与足量NaOH溶液共热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+NH3↑+2H2O | |
| C. | 明矾净水:Al3++3H2O═Al(OH)3↓+3H+ | |
| D. | 苯酚加入NaHCO3溶液中:C6H5OH+HCO3-→C6H5O-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
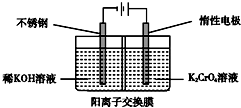
| A. | 在阴极室,发生的电极反应为2H2O+2e-═2OH-+H2↑ | |
| B. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| C. | 该制备过程中总反应的化学方程式为4K2CrO4+4H2O$\frac{\underline{\;通电\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+O2↑ | |
| D. | 测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr)为d,则此时铬酸钾的转化率为1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质和油脂都属于高分子化合物,一定条件下都能水解 | |
| B. | 甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同 | |
| C. | 乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2 | |
| D. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | A | B | C | D |
| 甲中气体 | H2S | H2 | NH3 | NO |
| 乙中气体 | SO2 | Cl2 | HCl | O2 |
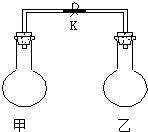
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com