
| A. | 水玻璃可用于制备硅胶和木材防火剂 | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| C. | 煤的气化是物理变化,是高效、清洁地利用煤的重要途径 | |
| D. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
分析 A.水玻璃为硅酸钠的水溶液具有粘性,硅酸钠熔点高,不易燃烧;
B.水果中产生的乙烯具有催熟效力,高锰酸钾能够氧化乙烯;
C.煤的气化有新物质生成;
D.二氧化碳在水中溶解度较小,但是在碱性环境条件下溶解性很大;
解答 解:A.水玻璃为硅酸钠的水溶液具有粘性,硅酸钠熔点高,不易燃烧,可用于制备硅胶和木材防火剂,故A正确;
B.用浸泡过高锰酸钾溶液的硅藻土保鲜水果,可以氧化产生的乙烯,延长保质期,故B正确;
C.煤的气化有新物质生成,属于化学变化,故C错误;
D.二氧化碳在水中溶解度较小,但是在碱性环境条件下溶解性很大,所以在侯氏制碱法中应该先通入氨气然后再通入二氧化碳,故D正确;
故选:C.
点评 本题考查较为综合,侧重于化学与生活、生产的考查,有利于培养学生的良好的科学素养,提高学生学习的积极性,题目难度不大,注意相关基础知识的积累.


 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:解答题
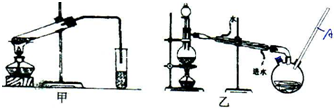
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 称量时,左盘低,右盘高 | B. | 定容时俯视读取刻度 | ||
| C. | 原容量瓶洗净后未干燥 | D. | 定容时液面超过了刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2+Na2SO4═BaSO4↓+2NaOH | B. | BaCl2+Na2SO4═BaSO4↓+2NaCl | ||
| C. | BaCO3+H2SO4═BaSO4↓+CO2↑+H2O | D. | BaCl2+H2SO4═BaSO4↓+2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
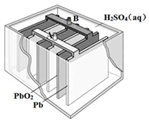 铅蓄电池是最常见的二次电池,其构造示意图如下.发生反应的化学方程式为:
铅蓄电池是最常见的二次电池,其构造示意图如下.发生反应的化学方程式为:| A. | 放电时,电解质溶液的PH值增大 | |
| B. | 放电时,电路中转移0.2mol电子时Pb电极质量减少20.7g | |
| C. | 放电时,溶液中H+向PbO2电极移动 | |
| D. | 放电时,正极反应为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-═PbSO4(s)+2H2O(l) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱碱性溶液中:Na+、K+、Cl-、HCO3- | |
| B. | “84”消毒液中:SiO32-、CO32-、Na+、S2- | |
| C. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| D. | 0.1 mol•L-1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
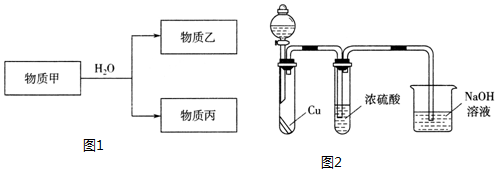
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2、HC1、H2O | B. | HC1、H2O、O2 | C. | HC1、H2O | D. | CO2、O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com