
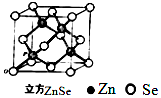
 硒化锌是一种透明色半导体,也可作为红光外学材料,熔点1520℃.
硒化锌是一种透明色半导体,也可作为红光外学材料,熔点1520℃.分析 (1)Zn是30号元素,其原子核外有30个电子,其3d、4s电子为其价电子;
(2)同一主族元素,元素电负性随着原子序数增大而减小;同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
(3)H2Se价层电子对个数是4且含有2个孤电子对,根据价层电子对互斥理论判断该分子空间构型及Se原子杂化方式;
(4)含有氢键的氢化物熔沸点较高;
(5)晶体中Zn原子的配位数为12;
(6)该晶胞中Zn原子个数为4、Se原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以该晶胞质量=$\frac{79+65}{{N}_{A}}×4$,根据晶体质量与晶胞质量确定晶胞个数.
解答 解:(1)Zn是30号元素,其原子核外有30个电子,其3d、4s电子为其价电子,其价电子排布式为3d104s2,故答案为:3d104s2;
(2)同一主族元素,元素电负性随着原子序数增大而减小,所以电负性Se<S;同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第一电离能Se<Sn,
故答案为:<;<;
(3)H2Se价层电子对个数是4且含有2个孤电子对,根据价层电子对互斥理论判断该分子空间构型及Se原子杂化方式分别为V形、sp3,
故答案为:V形;sp3;
(4)含有氢键的氢化物熔沸点较高,H2O含有氢键、H2Se不含氢键,导致H2O的沸点(100℃)高于H2Se的沸点(-42℃),故答案为:H2O含有氢键、H2Se不含氢键;
(5)锌单质晶体是六方最密堆积,根据锌金属的晶体结构示意图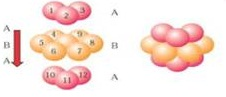 可知,原子按“ABABAB”方式堆积,晶体中Zn原子的配位数为12,故答案为:12;
可知,原子按“ABABAB”方式堆积,晶体中Zn原子的配位数为12,故答案为:12;
(6)该晶胞中Zn原子个数为4、Se原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以该晶胞质量=( $\frac{79+65}{{N}_{A}}×4$)g,晶胞个数=$\frac{144g}{(\frac{79+65}{{N}_{A}}×4)g}$=$\frac{{N}_{A}}{4}$,
故答案为:$\frac{{N}_{A}}{4}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子杂化方式判断、氢键、元素周期律等知识点,侧重考查学生分析、判断、计算及空间想象能力,难点是晶胞计算及配位数计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 能全部透过半透膜 | B. | 没有丁达尔现象 | ||
| C. | 所得液体透过滤纸 | D. | 所得物质一定是浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用KI鉴别淀粉溶液和Na2CO3溶液 | |
| B. | 隔夜蔬菜中的部分硝酸盐被氧化为有毒的亚硝酸盐 | |
| C. | 沾附水滴的铁质餐具生锈是化学腐蚀所致 | |
| D. | 白葡萄酒含维生素C 等多种维生素,通常添加微量SO2,以防止营养成分被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol/L | 0.21 | 0.17 | 0.14 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向蒸馏水中加入Na2O,水的电离程度变小 | |
| B. | 向0.1mol•L-1的醋酸溶液中加水稀释后溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 | |
| C. | 向0.1mol•L-1的醋酸溶液中加水稀释后溶液中$\frac{c({H}^{+})}{c(C{H}_{3}CO{O}^{-})}$不变 | |
| D. | 向0.1mol•L-1的醋酸溶液稀释到原体积的10倍后,溶液的PH=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验过程 | 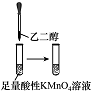 | 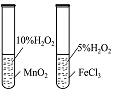 | 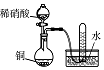 |  |
| 实验目的 | 将乙二醇(HOCH2CH2OH)转化为乙二酸(H2C2O4) | 比较氯化铁和二氧化锰对H2O2分解反应的催化效果 | 证明稀硝酸与铜反应时表现出氧化性 | 用SO2与Ba(NO3)2反应获得BaSO3沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液呈酸性,可用氯化铁溶液蚀刻铜电路板 | |
| B. | 铝的金属性比钒强,可用铝与五氧化二钒反应制取金属钒 | |
| C. | 二氧化锰具有强氧化性,能将双氧水氧化为氧气 | |
| D. | 二氧化硫具有漂白性,能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
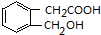
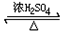
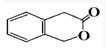 +H2O(有机物须用结构简式表示)
+H2O(有机物须用结构简式表示)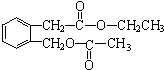 ;反应④的反应类型是消去反应.
;反应④的反应类型是消去反应. .
.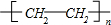 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com