
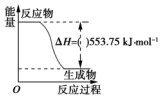
 (1)运动会中的火炬一般采用丙烷(C3H8)为燃料.丙烷热值较高,污染较小,是一种优良的燃料.试回答下列问题:
(1)运动会中的火炬一般采用丙烷(C3H8)为燃料.丙烷热值较高,污染较小,是一种优良的燃料.试回答下列问题:分析 (1)①分析图象得到生成1mol水的焓变△H=-553.75KJ/mol;
②依据热化学方程式书写方法写出,注意物质聚集状态,对应量下的焓变;
(2)①依据热化学方程式和盖斯定律计算所需热化学方程式,46g液态无水酒精物质的量=$\frac{46g}{46g/mol}$=1mol;
②设计实验、利用盖斯定律计算C(s)+$\frac{1}{2}$O2(g)═CO(g)的△H,需要知道碳和一氧化碳的燃烧热才能计算得到.
解答 解:(1)①图象是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,丙烷燃烧反应放热△H=-553.75KJ/mol,故答案为:-;
②丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,反应放热△H=-553.75KJ/mol;则写出的热化学方程式为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H1=-2215.0 kJ/mol,故答案为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H1=-2215.0 kJ/mol;
(2):①a、H2O(g)═H2O(l)△H1=-Q1 kJ/mol
b、C2H5OH(g)═C2H5OH(l)△H2=-Q2 kJ/mol
c、C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=-Q3 kJ/mol
依据盖斯定律计算c-3a+b得到,46g液态无水酒精物质的量=$\frac{46g}{46g/mol}$=1mol,完全燃烧,生成气态CO2和液态H2O的热化学方程式为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H3=-( Q3-3Q1+Q2) kJ/mol,
故答案为:(Q3-3Q1+Q2) kJ;
②设计实验、利用盖斯定律计算C(s)+$\frac{1}{2}$O2(g)═CO(g)的△H,需要知道碳和一氧化碳的燃烧热才能计算得到,
故答案为:碳和一氧化碳的燃烧热.
点评 本题考查了热化学方程式的书写方法,盖斯定律的计算应用,掌握热化学方程式的意义和盖斯定律的应用是解题关键,题目难度中等.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:选择题
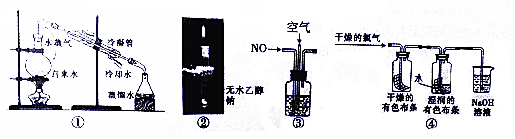
| A. | 图①用于除去自来水中的Fe3+、C1-等杂质离子 | |
| B. | 图②中直接点燃气体,证明钠与乙醇反应的气体产物是H2 | |
| C. | 图③在探究NO充分转化成HNO3的实验中,观察气泡速率控制通入气体体积比 | |
| D. | 图④用该实验可以证明Cl2体现漂白作用的原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水光照颜色变浅 | |
| B. | 使用排饱和食盐水的方法收集氯气 | |
| C. | H2、I2、HI平衡混合气加压颜色变深 | |
| D. | 把有缺陷的胆矾晶体,投入饱和的硫酸铜溶液,一段时间后,晶体变为规则结构. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过滤的方法可以除去食盐水中的泥沙 | |
| B. | 酒精灯加热烧瓶时不用垫石棉网 | |
| C. | 氯化氢气体能使干燥的蓝色石蕊试纸变红 | |
| D. | 盛放氢氧化钠溶液的玻璃瓶,可以使用橡胶塞或玻璃塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
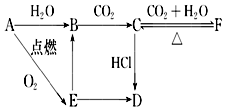 A、B、C、D、E、F六种含有相同元素的物质有如图变化关系,E是淡黄色粉末:
A、B、C、D、E、F六种含有相同元素的物质有如图变化关系,E是淡黄色粉末:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
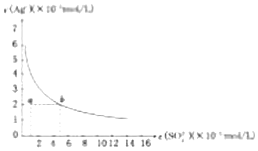
| A. | 在SO42-浓度为3mol/L的溶液中肯定不存在Ag+ | |
| B. | 0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合不会生成沉淀 | |
| C. | 在任何存在Ag2SO4的悬浊溶度积中c(Ag+)=2c(SO42-) | |
| D. | a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| t/min | 1 | 2 | 3 | 4 |
| c(N2O5)/mol.L-1 | 0.133 | 0.080 | 0.057 | 0.040 |
| v正/mol.L-1.min-1 | 0.0466 | 0.028 | 0.020 | 0.014 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com