
| A. | K | B. | Ca | C. | I | D. | Ne |
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L N2O4中含有的分子数目为0.5NA | |
| B. | 常温常压下,10.4g苯乙烯中含有的碳碳双键数目为0.1NA | |
| C. | 标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA | |
| D. | 常温常压下,0.1mol单质硅和二氧化硅中含有的共价键数目都是0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ② | C. | ①③ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在电流的作用下,氖原子与构成灯管的物质发生反应 | |
| B. | 电子由激发态向基态跃迁时以光的形式释放能量 | |
| C. | 氖原子获得电子后转变成发出红光的物质 | |
| D. | 电子由基态向激发态跃迁时吸收除红光以外的光线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.
,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| D | ||
| A | B | C |
| E |
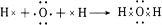 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有③④ | B. | 只有①②⑤ | C. | 只有①②③ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺磺化得到:
对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺磺化得到: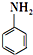 +H2SO4$\stackrel{170-180℃}{→}$
+H2SO4$\stackrel{170-180℃}{→}$ +H2O
+H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com