
| A. | ①③⑤ | B. | ③④ | C. | ②④⑤ | D. | ③④⑤ |
分析 ①由同种物质组成的为纯净物,包括单质和化合物;
②单质是由同种元素组成的纯净物,化合物是由不同种元素组成的纯净物;
③在水溶液里或熔融状态下完全电离的是强电解质,部分电离的是弱电解质;
④由同种元素形成的不同种单质互为同素异形体,互为同素异形体的物质要符合以下两个条件:同种元素形成,不同单质;
⑤胶体的本质特征是分散质微粒直径在1nm-100nm间.
解答 解:①铝热剂为铝与金属氧化物的混合物,矿泉水中含有水和矿物质,属于混合物,冰水只有水这一种物质,为纯净物,故①错误;
②HD是由同种氢元素组成的单质:氢气,不是化合物,故②错误;
③明矾、烧碱、硫酸均为强电解质,故③正确;
④C60、金刚石、石墨均为碳元素的不同单质,互为同素异形体,故④正确;
⑤碘酒是碘单质的酒精溶液,不属于胶体,故⑤错误;
故选B.
点评 本题考查了化学基本概念的理解和应用,熟悉混合物、化合物、单质、化合物、电解质、非电解质等概念的分析即可判断,掌握物质的组成是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
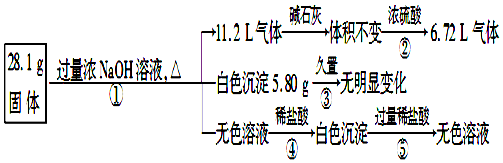
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)如图是一种常见有机物的比例模型,该模型图可代表一种D(填代号,下同)
(1)如图是一种常见有机物的比例模型,该模型图可代表一种D(填代号,下同)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
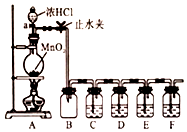 某化学学习小组为探究Cl2、Br2、I2、Fe3+的氧化性强弱,设计了如图实验装置:
某化学学习小组为探究Cl2、Br2、I2、Fe3+的氧化性强弱,设计了如图实验装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由H2、I2、HI三种气体组成的平衡体系加压后颜色变深 | |
| B. | 对2SO2+O2?2SO3△H<0的反应,使用催化剂可加快反应的速率 | |
| C. | 实验室可用浓氨水和氢氧化钠固体快速制取氨气 | |
| D. | N2(g)+3H2(g)?2NH3(g)△H<0,500℃左右比室温更有利于合成NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 现 象 | 解释或结论 | |
| A | SO2使酸性高锰酸钾溶液褪色 | SO2表现漂白性 |
| B | 向某溶液中加入BaCl2溶液和稀HNO3,若有白色沉淀生成 | 原溶液中含SO42- |
| C | 用铂丝蘸取某溶液在酒精灯火焰上灼烧直接观察火焰颜色,未见紫色 | 原溶液中不含K+ |
| D | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色. | Fe3+的氧化性比I2的强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com