
【题目】设NA为阿伏加德罗常数的值,下列说法错误的是
A.常温常压下,4gD2O中含有的电子数为2NA
B.42gC2H4和C4H8的混合气中含有氢原子数为6NA
C.H2O(g)通过Na2O2(s)使其增重bg时,反应中转移的电子数为![]()
D.25℃时,1LpH=1的HCl溶液中含有的H原子数为0.1NA
【答案】D
【解析】
A.D2O的M=20g/mol,1个D2O分子中有10个电子,故4gD2O中含有的电子物质的量为![]() ×10=2mol,电子数为2NA,A项正确;
×10=2mol,电子数为2NA,A项正确;
B.设C2H4和C4H8的质量分别为x、y,则有:x+y=42g,则C2H4和C4H8的混合物中H原子物质的量为![]() ,含氢原子数为6NA,B项正确;
,含氢原子数为6NA,B项正确;
C.H2O(g)通过Na2O2(s)发生反应:2H2O+2Na2O2=4NaOH+O2↑,由方程式可知,2Na2O2→4NaOH~2e-,固体质量每增加4g,转移电子数为2 NA,现增重bg,则转移的电子数应为![]() ,C项正确;
,C项正确;
D.HCl溶液中的H原子来源于两部分,一部分是以离子形式存在于溶液中的H+,一部分是以H2O分子形式存在的H原子,25℃时,1LpH=1的HCl溶液中含有的H+数目为0.1NA,该溶液中H原子数应>0.1NA,D项错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】某同学称取9.00g淀粉溶于水,测定淀粉的水解百分率.其程序如下:
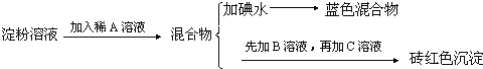
试回答下列问题:
(1)各步加入的试剂为:A_________,B_________,C_________;
(2)加入A溶液而不加入B溶液是否可以_________,其理由是_________;
(3)写出淀粉水解的方程式_________;
(4)当析出1.44g砖红色沉淀时,淀粉水解率是_________;[已知葡萄糖与Cu(OH)2反应的化学方程式为:CH2OH(CHOH)4CHO+2Cu(OH)2![]() CH2OH(CHOH)4COOH+Cu2O↓+2H2O]。
CH2OH(CHOH)4COOH+Cu2O↓+2H2O]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。AC2是非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子在外界。根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为_________;
(2)B的氢化物的分子立体构型是_____;其中心原子采取_______杂化。
(3)写出化合物AC2的电子式为_______;一种由B、C组成的化合物与AC2互为等电子体,其化学式为______。
(4)E的核外电子排布式是______,ECl3形成的配合物的化学式为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向20 mL l mol/L的某二元弱酸H2X溶液中逐渐加入NaOH固体(忽略溶液温度及体积变化),测得溶液中的H2X、HX-、X2-的物质的量浓度与溶液pH变化关系如图。下列叙述错误的是( )
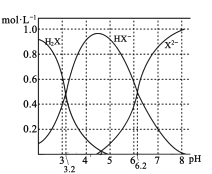
A.NaHX的水溶液呈酸性
B.当加入NaOH固体0.01 mol时,溶液pH= 3.2
C.当加入NaOH固体0.02 mol时,溶液中的离子浓度大小关系为:c(Na+)>c(HX-)>c(H+)>c(X2-)> c(OH-)
D.当加入NaOH固体0.04 mol时,溶液中水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(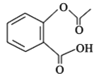 )是一种用途很广的消炎镇痛药物。可以通过以下方法合成:
)是一种用途很广的消炎镇痛药物。可以通过以下方法合成:

已知:
![]() +
+![]()
![]()
![]() +HCl
+HCl
3CH3COOH+PCl3→3CH3COCl+H3PO3
请回答下列问题:
(1)阿司匹林中的含氧官能团有____(写名称),反应①的化学反应类型为____。
(2)通过水杨酸还可制得香料E和高分子化合物G:
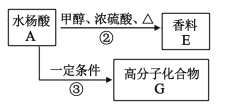
①请写出A→E的化学反应方程式____。
②已知G是一种聚酯,请写出其结构简式____。
(3)写出水杨酸所有属于芳香酯的同分异构体的结构简式____。
(4)结合题中信息,以苯酚、异丁烯为原料(其它无机原料自选)合成聚合物 的流程路线如下:
的流程路线如下:![]()
![]() ……→
……→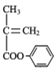 →
→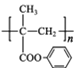 。请完善合成流程省略部分____。
。请完善合成流程省略部分____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解尿素[CO(NH3)2]的碱性溶液制氢气的装置如图所示。下列说法错误的是
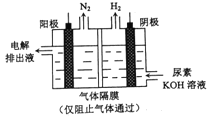
A. 为增强导电性,可用金属铜作阳极
B. 电解过程中阴、阳极产生的气体物质的量之比为3:1
C. 阴极的电极反应式为:2H2O+2e-=H2+2OH-
D. 阳极的电极反应式为:CO(NH2)2-6e-+8OH-=CO32-+N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.22.4L乙烯中C-H键数为4NA
B.1.5g甲基中电子数为1.0NA
C.标准状况下,22.4L苯中含有的碳原子数为6.0NA
D.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁在元素周期表中的位置为_____,基态铁原子有个未成对电子_____,三价铁离子的电子排布式为_____。
(2)基态Si原子中,电子占据的最高能层符号_____,该能层具有的原子轨道数为_____;铝元素的原子核外共有_____种不同运动状态的电子、_____种不同能级的电子。
(3)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用_____形象化描述。在基态14C原子中,核外存在_____对自旋相反的电子。
(4)中国古代四大发明之一——黑火药,它的爆炸反应为:2KNO3+3C+S![]() K2S+N2↑+3CO2↑,除S外,上述元素的电负性从大到小依次为_____,第一电离能从大到小依次为_____。
K2S+N2↑+3CO2↑,除S外,上述元素的电负性从大到小依次为_____,第一电离能从大到小依次为_____。
(5)有以下物质:①HF,②Cl2,③H2O,④N2,⑤C2H4,⑥CH4,⑦H2,⑧H2O2,⑨HCN(H—C≡N),⑩Ar,既有σ键又有π键的是______;含有由两个原子的s轨道重叠形成的σ键的是______;不存在化学键的是______。
(6)在BF3分子中,F—B—F的键角是______,硼原子的杂化轨道类型为______,BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠离子电池相比锂离子电池具有高安全、长寿命、低成本的特点,有望成为下一代电池。某钠离子电池放电时的总反应为Na(1-x)MO2+NaxCn═NaMO2+nC,如图表示其充电过程。有关该电池的说法错误的是( )
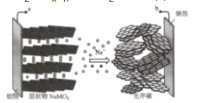
A.充电时,a与外加电源正极相连
B.放电时,外电路电子由b流向a
C.充电时,无序碳上发生的反应为nC+xNa++xe-═NaxCn
D.用该电池电解精炼铜,当电池中迁移1molNa+时,理论上可获得64g纯铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com