
选择一种容积将溴水中的溴萃取出来,这种溶剂应该具有的性质
A.易溶于水,且不与溴发生反应 B.不溶于水,且密度必须比水小
C.不溶于水,且密度必须比水大 D.不溶于水,且比水更容易使溴溶解
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
下列物质的水溶液能导电,但属于非电解质的是
A.Na2S B. Cl2 C. NaHCO3 D. CO2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学a卷(解析版) 题型:选择题
若m g氧气含n个氧气分子,则阿伏伽德罗常数为
A.2n B.16n/m C.n D.32n/m
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:填空题
请根据所学知识回答下列问题:
(1)同温同压下,反应H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,ΔH1____________ΔH2(填“>”“<”或“=”下同)。
(2)相同条件下,2 mol氢原子所具有的能量____________1 mol 氢分子所具有的能量。
(3)已知:常温下,0.01 mol·L-1 MOH溶液的pH为10,MOH(aq)与H2SO4(aq)反应生成1 mol可溶正盐的ΔH=-24.2 kJ·mol-1,强酸与强碱的稀溶液的中和热为ΔH=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为_______________
(4)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
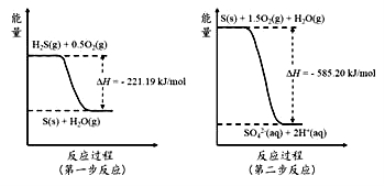
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为______________________。
(5)一定条件,在水溶液中1 mol Cl-、ClO x-(x=1,2,3,4)的能量(KJ)相对大小如图所示。
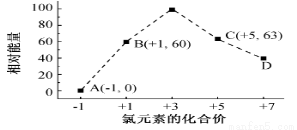
①D是______________________ (填离子符号)。
②B→A+C反应的热化学方程式为______________________ (用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
甲容器进行A→ B的反应,ΔH<0,反应速率为v1,在t1温度下进行;乙容器进行C→D的反应,ΔH>0,反应速率为v2,在t2温度下进行。对于上述反应,下列说法正确的是
A.若t1 > t2,则v1>v2
B.甲容器内每分钟减少4mol A,乙容器内每分钟减少2mol C,则甲容器内的反应速率比乙容器内的反应速率快
C.当温度升高时v1增大,v2减小
D.在甲、乙容器中分别加入MnO2,v1、v2不一定加快
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
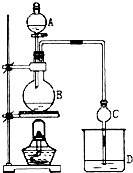 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知 ①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知 ①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点:| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
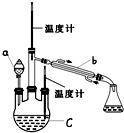 某实验小组用如图所示装置(略去加热装置)制备 乙酸乙酯.
某实验小组用如图所示装置(略去加热装置)制备 乙酸乙酯. 浓硫酸溶于乙醇不是简单的物理溶解,而是伴随着化学变化,生成硫酸乙酯和硫酸二乙酯,请写出乙醇和硫酸反应生成硫酸二乙酯的方程式2C2H5OH+H2SO4→(OC2H5)2SO2+2H2O.
浓硫酸溶于乙醇不是简单的物理溶解,而是伴随着化学变化,生成硫酸乙酯和硫酸二乙酯,请写出乙醇和硫酸反应生成硫酸二乙酯的方程式2C2H5OH+H2SO4→(OC2H5)2SO2+2H2O.| 乙醇 | 乙酸 | 乙酸乙酯 | |
| 沸点 | 78.0℃ | 117.9℃ | 77.5℃ |
| 水溶性 | 易溶 | 易溶 | 难溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com