

| A. | X难溶于乙醇 | |
| B. | 酒中的少量丁酸能抑制X的水解 | |
| C. | X完全燃烧后生成CO2和H2O的物质的量比为1:1 | |
| D. | 分子式为 C5H10O2且能与NaHCO3溶液反应生成气体的物质有5种 |
分析 A.该物质中含有酯基,具有酯的性质,该物质易溶于有机溶剂;
B.该物质为丁酸乙酯,一定条件下能发生水解反应生成丁酸和乙醇;
C.该物质分子式为C6H12O2,根据原子守恒判断X完全燃烧生成二氧化碳和水的物质的量之比;
D.分子式为 C5H10O2且能与NaHCO3溶液,应含有羧基,同分异构体取决于-C4H9.
解答 解:A.该物质中含有酯基,具有酯的性质,根据相似相溶原理知,该物质易溶于有机溶剂乙醇,故A错误;
B.该物质为丁酸乙酯,一定条件下能发生水解反应生成丁酸和乙醇,所以酒中的少量丁酸能抑制X水解,故B正确;
C.该物质分子式为C6H12O2,根据原子守恒判断X完全燃烧生成二氧化碳和水的物质的量之比,X完全燃烧后生成CO2和H2O的物质的量比为1:1,故C正确;
D.分子式为 C5H10O2且能与NaHCO3溶液,应含有羧基,同分异构体取决于-C4H9,同分异构体有4种,故D错误.
故选BC.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断及计算能力,涉及同分异构体种类判断、酯的性质、根据方程式的计算等知识点,明确官能团及其性质关系是解本题关键,易错选项是D,注意同分异构体的判断,题目难度不大.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因铝表面能形成致密的氧化膜,所以铝制餐具可以长期使用 | |
| B. | 钢铁设备连接锌块或电源正极都可防止其腐蚀 | |
| C. | 新买的衣服先用水清洗,可除去衣服上残留的有防皱作用的甲醛整理剂 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2与稀硝酸反应:H++OH-=H2O | |
| B. | 铜片与浓硝酸反应:Cu+4H++2 NO3-=Cu2++2NO2↑+2H2O | |
| C. | 氨水与MgCl2溶液反应:Mg2++2OH-=Mg(OH)2↓ | |
| D. | 铁与稀硝酸反应:Fe+2H+=Fe2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
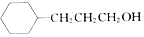 ,流程如下
,流程如下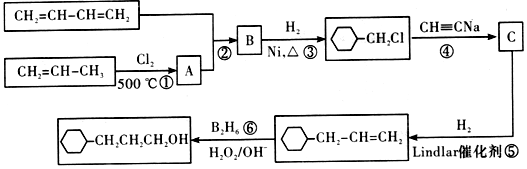
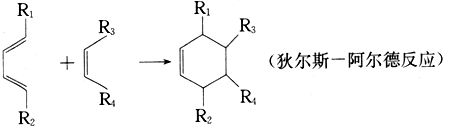
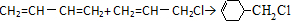
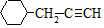
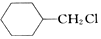 含有六元环且核磁共振氢谱有4组峰值的同分异构体的结构筒式
含有六元环且核磁共振氢谱有4组峰值的同分异构体的结构筒式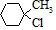
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 世界上最早现并使用锌的是中国,明朝末年《天工开物》一书中有世界上最早的关于炼锌技术的记载.回答下列问題:
世界上最早现并使用锌的是中国,明朝末年《天工开物》一书中有世界上最早的关于炼锌技术的记载.回答下列问題:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 脱氧过程是吸热反应,可降低温度,延长食品保质期 | |
| B. | 脱氧过程中炭作原电池正极,电极反应为4H++O2+4e-═2H2O | |
| C. | 含有0.56g铁粉的脱氧剂,理论上最多能吸收氧气168mL (标准状况) | |
| D. | 该过程实现了电能到化学能的转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O | |
| B. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | |
| C. | Mg+2HCl=MgCl2+H2↑ | |
| D. | C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com