
【题目】在某100 mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4 mol·L1、0.2 mol·L1。向该混合液中加入1.92 g铜粉,加热,待充分反应后(假设反应前后溶液体积不变),所得溶液中的Cu2+的物质的量浓度(mol·L1)是( )
A. 0.15 B. 0.225 C. 0.3 D. 0.45
科目:高中化学 来源: 题型:
【题目】在恒温、体积为2L的密闭容器中加入1molCO2和3molH2,发生如下的反应:
CO2(g)+3H2(g)![]() CH3OH(g) +H2O(g) △H<0。
CH3OH(g) +H2O(g) △H<0。
可认定该可逆反应在一定条件下已达到化学平衡状态的是( )
A.容器中CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1 ∶1
B.v正(CO2)=3v逆(H2)
C.容器内混合气体平均相对分子质量保持不变
D.容器中CO2、H2、CH3OH、H2O的物质的量浓度都相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸钠可用于制备高氯酸.以精制盐水等为原料制备高氯酸钠晶体(NaClO4H2O)的流程如下: 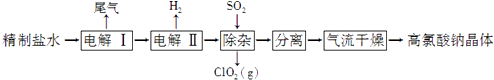
(1)由粗盐(含Ca2+、Mg2+、 ![]() 、Br﹣等杂质)制备精制盐水时需用到NaOH、BaCl2、Na2CO3等试剂.Na2CO3的作用是;除去盐水中的Br﹣可以节省电解过程中的电能,其原因是 .
、Br﹣等杂质)制备精制盐水时需用到NaOH、BaCl2、Na2CO3等试剂.Na2CO3的作用是;除去盐水中的Br﹣可以节省电解过程中的电能,其原因是 .
(2)“电解Ⅰ”的目的是制备NaClO3溶液,产生的尾气除H2外,还含有(填化学式).“电解Ⅱ”的化学方程式为 .
(3)“除杂”的目的是除去少量的NaClO3杂质,该反应的离子方程式为 . “气流干燥”时,温度控制在80~100℃的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于![]() 的叙述错误的是
的叙述错误的是
A. 原子序数116 B. 中子数177
C. 核外电子数116 D. 相对原子质量293
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在加热下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)元素名称: A ______ B _____ C _____ D ______
(2)D元素位于周期表中___________周期____________族
(3)写出AB2与C2B2反应的化学方程式:________________________________________。
(4)电子式表示化合物 C2D 的形成过程:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质久置于空气中会发生相应的变化,其中发生了氧化还原反应的是
A. 浓硫酸的质量增重 B. 澄清的石灰水变浑浊
C. 氢氧化钠的表面发生潮解 D. 钠的表面变暗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将2molSO2和1molO2充入2L密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ/mo!,下列说法中正确的是
2SO3(g) △H=-197kJ/mo!,下列说法中正确的是
A. 反应达到平衡状态时,会放出197kJ的热量
B. 增大O2浓度可以使SO2转化率达到100%
C. 使用合适的催化剂、升高温度均可加大反应速率
D. 反应达到平衡时,正反应和逆反应的化学反应速率相等且不为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,满足下列条件的溶液一定呈酸性的是( )
A.能与金属Al反应放出H2的溶液
B.加酚酞后显无色的溶液
C.pH=6的某溶液
D.c(H+)>c(OH﹣)的任意水溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com