
化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 kJ。该反应的热化学方程式为____________________________________________。
(2)反应AX3(g)+X2(g)AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
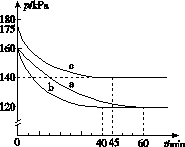
①列式计算实验a从反应开始至达到平衡时的反应速率v(AX5)=______________________。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为____________(填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b________________________________________________,c____________________________________________。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为______________;实验a和c的平衡转化率:αa为________,αc为________。
(1)AX3(l)+X2(g)===AX5(s) ΔH=-123.8 kJ/mol (2)①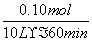 =1.7×10-4 mol·L-1·min-1
=1.7×10-4 mol·L-1·min-1
解:开始时n0=0.4 mol,总压强为160 kPa,平衡时总压强为120 kPa,则n为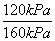 =
=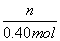 ,
,
n=0.40 mol×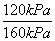 =0.30 mol,
=0.30 mol,
AX3(g)+X2(g)  AX5(g)
AX5(g)
起始时n0/mol:0.20 0.20 0
平衡时n/mol:0.20-x 0.20-x x
(0.20-x)+(0.20-x)+x=0.30
x=0.10
v(AX5)=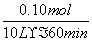 =1.7×10-4 mol·L-1·min-1
=1.7×10-4 mol·L-1·min-1
②bca 加入催化剂。反应速率加快,但平衡点没有改变 温度升高。反应速率加快,但平衡点向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大) ③α=2(1-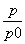 ) 50% 40%
) 50% 40%
[解析] (1)书写热化学方程式时要注意常温下AX3呈液态,AX5呈固态。(2)②由图像知,达到平衡所需时间:a>c>b,所以反应速率v(AX5)由大到小的顺序为b>c>a;与实验a相比,实验b先达到平衡,化学反应速率快,但平衡点没有变化,说明实验b加入了催化剂;反应为放热反应,与实验a相比,实验c平衡向逆反应方向移动,且反应速率加快,说明实验c改变的条件是升高温度。
AX3(g) + X2(g) AX5(g)
AX5(g)
起始量(mol) 0.2 0.2 0
变化量(mol) x x x
平衡量(mol) 0.2-x 0.2-x x
则有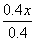 =
=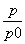 ,解得x=
,解得x=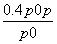 ,则AX3的转化率为
,则AX3的转化率为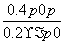 =2(1-
=2(1-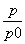 );分别将实验a、c的p、p0的数据代入上式,得aa、ac分别为50%、40%。
);分别将实验a、c的p、p0的数据代入上式,得aa、ac分别为50%、40%。


科目:高中化学 来源: 题型:
下列叙述错误的是( )
A.SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同
B.制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸
C.用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率
D.用AgNO3溶液可以鉴别KCl和KI
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度和压强下,由3种炔烃(分子中只含一个CC)组成的混合气体4g与足量的H2充分反应加成后生成4.4g三种对应的烷烃,则所得烷烃中一定有( )
A.异丁烷 B.乙烷
C.丙烷 D.丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1;反应的平衡常数K1为________。
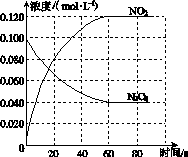
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是____________________________。
②列式计算温度T时反应的平衡常数K2:_______________________________________
________________________________________________________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是__________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硝基苯甲酸乙酯在OH-存在下发生水解反应:
O2NC6H4COOC2H5+OH-O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050 mol·L-1,15 ℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。回答下列问题:
| t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
| α/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
(1)列式计算该反应在120~180 s与180~240 s 区间的平均反应速率________、________;比较两者大小可得出的结论是____________________。
(2)列式计算15 ℃时该反应的平衡常数________。
(3)为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可采取的措施有________(要求写出两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
运用相关化学知识进行判断,下列结论错误的是( )
A.某吸热反应能自发进行,因此该反应是熵增反应
B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中
C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇是重要的有机化工原料,可由乙烯气相直接水合法生产或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇。写出相应反应的化学方程式:________________________________________。
(2)已知:
甲醇的脱水反应
2CH3OH(g)===CH3OCH3(g)+H2O(g)
ΔH1=-23.9 kJ·mol-1
甲醇制烯烃的反应
2CH3OH(g)===C2H4(g)+2H2O(g)
ΔH2=-29.1 kJ·mol-1
乙醇的异构化反应 C2H5OH(g)===CH3OCH3(g)
ΔH3=+50.7 kJ·mol-1
则乙烯气相直接水合反应C2H4(g)+H2O(g)===C2H5OH(g)的ΔH________kJ·mol-1。与间接水合法相比,气相直接水合法的优点是____________________________________。
(3)如图所示为气相直接水合法中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。
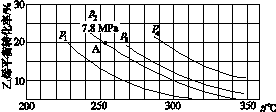
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=____________________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②图中压强(p1、p2、p3、p4)的大小顺序为____,理由是___________________。
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃、压强6.9 MPa,n(H2O)∶n(C2H4)=0.6∶1。乙烯的转化率为5%,若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可采取的措施有________________________________________________________________________、
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是( )
A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
B.2NO(g)+2CO(g)===N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
C.加热0.1 mol·L-1Na2CO3溶液,CO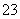 的水解程度和溶液的pH均增大
的水解程度和溶液的pH均增大
D.对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图所示)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
| 编号 | 实验目的 | 炭粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 醋酸浓度的影响 | 0.5 | 36.0 | |
| ③ | 0.2 | 2.0 | 90.0 |

(2)编号①实验测得容器中的压强随时间的变化如图(a)所示。t2时,容器中压强明显小于起始压强,其原因是铁发生了________腐蚀,请在图(b)中用箭头标出发生该腐蚀时电子的流动方向;此时,炭粉表面发生了________(填“氧化”或“还原”)反应,其电极反应式是__________。


(a) (b)
(3)该小组对图(a)中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:________;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,写出实验步骤和结论。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com