
分析 (1)根据元素的化合价和物质的性质分析;
(2)①Zn+2HCl=ZnCl2+H2↑中,HCl中H元素的化合价降低;
②NaOH+HCl=NaCl+H2O中,没有元素的化合价变化,为中和反应;
③2HCl$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑中,H元素的化合价降低,Cl元素的化合价升高;
(3)利用双线桥表示电子转移,由反应物指向生成物,表示同种元素之间电子得失情况,并注明电子转移数目.
解答 解:(1)在Cl2、Cl-、H+中氢元素处于最高价具有氧化性,氯气容易得电子具有较强的氧化性,所以具有氧化性的是Cl2、H+,其中氧化性最强的是Cl2,
故答案为:Cl2、H+;Cl2;
(2)①Zn+2HCl=ZnCl2+H2↑中,HCl中H元素的化合价降低,则体现其氧化性,反应中生成盐,还表现酸性,故答案为:氧化性、酸性;
②NaOH+HCl=NaCl+H2O中,没有元素的化合价变化,为中和反应,反应生成盐,表现酸性;故答案为:酸性;
③2HCl$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑中,H元素的化合价降低,Cl元素的化合价升高,所以HCl表现了氧化剂、还原剂,故答案为:氧化剂、还原剂;
(3)用双线侨法表示Zn+2HCl═ZnCl2+H2↑反应中电子转移的方向和数目为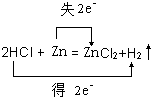 ;
;
用双线侨法表示2HCl$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑反应中电子转移的方向和数目为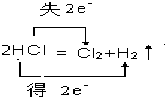 ,故答案为:
,故答案为: ,
, .
.
点评 本题考查氧化还原反应的综合应用,题目难度中等,注意从化合价的角度分析,计算时注意氧化还原反应中氧化剂和还原剂之间得失电子数目相等,表现为化合价升降总数相等.


科目:高中化学 来源: 题型:选择题

| A. | 正极反应为AgCl+e-═Ag+Cl- | |
| B. | 当电路中转移0.01mole-时,交换膜左侧溶液中约减少0.02mol离子 | |
| C. | 若用NaCl溶液代替盐酸,则电池总反应随之改变 | |
| D. | 放电时,交换膜右侧中有大量白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
| A. | 氯化银、溴化银和碘化银的溶解度依次增大 | |
| B. | 将硫酸银溶解于水后,向其中加入少量硫化钠溶液,不能得到黑色沉淀 | |
| C. | 在5mL1.8×10-5 mol/L的NaCl溶液中,加入1滴(1mL约20滴)0.1 mol/L的AgNO3溶液,不能观察到白色沉淀 | |
| D. | 将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,可以有少量白色固体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的体积:10V甲≤V乙 | |
| B. | 水电离出的OH-浓度:10c(OH-)甲=c(OH-)乙 | |
| C. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 | |
| D. | 若分别与5mLpH=11的NaOH溶液反应,所得溶液可能显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第八列 |
 ,该同学所画的电子排布图违背了泡利原理;
,该同学所画的电子排布图违背了泡利原理;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 代号 | 信息 |
| A | 原子最外层电子数为内层电子数的2倍 |
| C | 形成的一种单质可抵御紫外线对地球生物的伤害 |
| D | 是一种非金属元素,属于卤族之一,形成的气体常温常压下为黄绿色 |
| E | 单质是生活中使用最广泛的金属 |
| F | 形成的一种化合物可用于醛基的检验 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯(溴):加入KI溶液,振荡,分液 | |
| B. | 乙烷(乙烯):通过盛有KMnO4溶液的洗气瓶 | |
| C. | 硝基苯(浓HNO3):将其倒入足量NaOH溶液中,振荡、静置,分液 | |
| D. | 乙烯(SO2):通过盛有溴水的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4mol | B. | 3.2mol | C. | 4.8mol | D. | 5.6mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com