
【题目】某兴趣小组在复习铁的冶炼时,在参考资料上发现以下一段文字:已知在不同的温度下,一氧化碳与铁的氧化物反应能生成另一种铁的氧化物(或铁单质)和二氧化碳,他们不禁产生了疑问:一氧化碳与氧化铁反应生成的黑色物质真的是铁粉吗?于是他们进行了以下探究:
[查阅资料]
资料一:铁粉和四氧化三铁粉末能被磁铁吸引而氧化亚铁(黑色)不能;
资料二:四氧化三铁中铁元素有+2、+3两种化合价,其化学式可用FeO·Fe2O3的形式表示。
[提出猜想]黑色物质可能是四氧化三铁、氧化亚铁和铁粉中的一种或几种。
[进行实验]兴趣小组收集了一氧化碳与氧化铁反应生成的黑色物质进行了下列实验:
实验方案 | 实验现象 | |
甲 | 取少量黑色物质用磁铁吸引 | 黑色物质全部被磁铁吸引 |
乙 | 取少量黑色物质加入30%热的盐酸中 | 无气泡、溶液颜色变为黄绿色 |
丙 | 取少量黑色物质加入硫酸铜溶液中 | 无任何现象 |
[实验结论]
(1)甲实验现象说明黑色物质中没有_______,乙、丙实验现象说明黑色物质中没有______;
(2)生成的黑色物质应为四氧化三铁;
(3)写出黑色粉末和热的盐酸反应的化学方程式_______________________________。
[拓展研究]
同学们对四氧化三铁产生了兴趣,从参考资料中找到氧化沉淀法生产复印用高档四氧化三铁粉的工艺流程简图。
[生产流程]
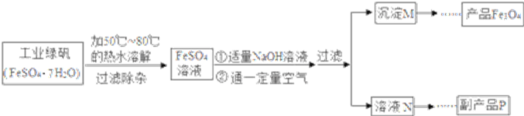
[查阅资料]
资料一:硫酸亚铁在不同温度下的溶解度如下表所示:
温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
资料二:氢氧化亚铁受氧气氧化反应原理为4Fe(OH)2+2H2O+O2===4Fe(OH)3
资料三:获得四氧化三铁的反应原理为Fe(OH)2+2Fe(OH)3![]() Fe3O4+4H2O
Fe3O4+4H2O
[问题讨论]
(1)溶解时,用50 ℃至80 ℃的热水目的是____________________________________。
(2)写出加入适量氢氧化钠溶液时发生反应的化学方程式________________________。
(3)上述过程中,要控制“通一定量空气”的目的是____________________________。
(4)要使四氧化三铁的产率最高,则上述流程中产生的氢氧化亚铁和氢氧化铁的最佳质量比为______________。
(5)副产品P是硫酸钠,由溶液N获得该副产品的操作顺序是b→_____→_____→d。_______
a.过滤
b.加热浓缩
c.冷却结晶
d.晶体加热至完全失去结晶水
[组成确定]
为确定用以上方法制得的四氧化三铁中可能含有的杂质,同学们又进行了下列实验探究。
[查阅资料]
资料一:难溶性碱受热时能分解产生金属氧化物和水(反应中各种元素的化合价不变);
资料二:氧化铁和一氧化碳反应是随温度升高而逐步进行的,先生成四氧化三铁,再生成氧化亚铁(黑色),最后生成铁。
[提出猜想]
四氧化三铁中可能含有的杂质是氧化铁和氧化亚铁中的一种或两种。
[实验设计]
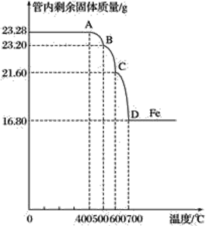
同学们称取了23.28 g该四氧化三铁样品进行了下列实验:

[实验分析]
因探究思路不同,兴趣小组分成甲、乙两小组。
甲组:
(1)该组同学欲通过B装置反应前后的质量变化来计算确认该四氧化三铁样品中的杂质,B中的最佳试剂是_________(填序号)。
①澄清石灰水 ②氢氧化钠浓溶液 ③稀盐酸 ④水
(2)上述实验过程中,一氧化碳气体除作为反应物外,还能起到的作用是:
①实验开始时,排尽装置中的空气,防止加热时发生爆炸;
②停止加热后,防止A中生成物被氧化,B中的溶液倒吸入A中;
③_____________________________________________。
(3)乙组同学认为B装置反应前后的质量差会偏小而影响计算、分析,你认为他们的理由是_______________________________________________。
乙组:
利用仪器测定并绘制成反应过程中A装置中玻璃管内的固体质量随温度的变化曲线(如图):
(1)写出BC段发生反应的化学方程式______________________________。
(2)通过计算确定:该四氧化三铁样品中含有的杂质是__________,其中含四氧化三铁的质量是____g。(不需要写过程)
【答案】氧化亚铁 铁 Fe3O4+8HCl=FeCl2+2FeCl3+4H2O 在50 ℃~80 ℃时,硫酸亚铁的溶解度较大,有利于溶解的更多,提高产率 2NaOH+FeSO4=Fe(OH)2↓+Na2SO4 防止氢氧化亚铁完全转化为氢氧化铁 90∶214(或45∶107) c a ② ③将装置中的二氧化碳通入氢氧化钠溶液中 一氧化碳从B中溶液里逸出时会带出部分水蒸气 Fe3O4+CO![]() 3FeO+CO2 氧化铁 20.88 g
3FeO+CO2 氧化铁 20.88 g
【解析】
[实验结论](1)根据题意FeO不能被磁铁吸引分析甲,根据铁能与盐酸、硫酸铜反应的性质分析乙、丙;
(3)根据金属氧化物与盐酸生盐和水,写出反应的方程式;
[问题讨论](1)根据硫酸亚铁的溶解度与温度的关系进行解答;
(2)根据碱和盐反应进行解答;
(3)根据反应条件可以影响反应的产物进行解答;
(4)根据质量守恒定律可知Fe(OH)2和Fe(OH)3的最佳质量比;
(5)根据硫酸钠的溶解性以及固体物质的分离方法进行解答;
【实验分析】
甲组:(1)根据氢氧化钠溶液用于吸收二氧化碳进行解答;
(2)根据一氧化碳还原四氧化三铁的作用进行解答;
(3)根据一氧化碳从B装置中流出要带走水蒸气进行解答;
乙组:(1)根据反应进行程度判断;
(2)根据氧元素的含量进行判断.根据铁元素质量守恒计算。
[实验结论]:
(1)实验甲中看到黑色物质全部被磁铁吸引,说明没有氧化亚铁;实验丙中取少量黑色物质加入硫酸铜溶液中无任何现象,说明没有铁;
(3)根据实验可知黑色固体为四氧化三铁,和盐酸反应生成氯化铁、氯化亚铁和水。黑色粉末和热的盐酸反应的化学方程式:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O;
[问题讨论]:
(1)根据图表中的信息可知,在50 ℃至80 ℃的热水中,硫酸亚铁的溶解度较大,利于溶解更多的硫酸亚铁,提高产率;
(2)氢氧化钠和硫酸亚铁反应生成氢氧化亚铁和硫酸钠:2NaOH+FeSO4=Fe(OH)2↓+Na2SO4 ;
(3)上述过程中,要控制“通一定量空气”的目的是控制氢氧化亚铁转化为氢氧化铁的量,防止氢氧化亚铁完全转化为氢氧化铁;
(4)要使四氧化三铁的产率最高,上述流程中产生的氢氧化亚铁与氢氧化铁的物质的量之比为1∶2,最佳质量比为90∶214(或45∶107);
(5)根据硫酸钠晶体的溶解度随温度的升高而增大,采用加热浓缩、冷却结晶的方法,再过滤,晶体加热至完全失去结晶水,得到硫酸钠,故答案为:c a ;
[实验结论]
甲组:(1)氢氧化钙的溶解性很小,不能保证把生成的二氧化碳全部吸收;二氧化碳溶解水的能力也不大,不能保证把生成的二氧化碳全部吸收;稀盐酸和二氧化碳不反应;只有氢氧化钠溶液保证把生成的二氧化碳全部吸收,故选用氢氧化钠浓溶液,即选②;
(2)上述实验过程中,一氧化碳气体除作为反应物外,还能起到的作用是:
①实验开始时,排尽装置中的空气,防止加热时发生爆炸;
②停止加热后,防止A中生成物被氧化,B中的溶液倒吸入A中;
③将装置中的二氧化碳通入氢氧化钠溶液中;
(3)一氧化碳从B中溶液里逸出时会带出部分水蒸气,而影响计算样品中杂质的质量;
乙组:(1)BC段发生反应的化学方程式:Fe3O4+CO![]() 3FeO+CO2;
3FeO+CO2;
(2)到700 ℃时只剩下铁,即此时氧化铁被一氧化碳还原为铁单质,
混合物中铁元素的质量分数=![]() ×100%=72.16%;
×100%=72.16%;
四氧化三铁铁元素的质量分数=![]() ×100%=72.4%;
×100%=72.4%;
氧化亚铁铁元素的质量分数=![]() ×100%≈77.8%;
×100%≈77.8%;
氧化铁铁元素的质量分数=![]() ×100%=70%,
×100%=70%,
所以该四氧化三铁样品中含有的杂质是氧化铁;
设混合物中含四氧化三铁的质量为x,则x×![]() ×100%+(23.28 g-x)×
×100%+(23.28 g-x)×![]() ×100%=16.80g,x=20.88g。
×100%=16.80g,x=20.88g。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述不正确的是( )
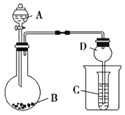
A.若A为浓盐酸,B为KMnO4,C中盛品红溶液,则C中溶液褪色
B.若A为醋酸,B为贝壳,C中盛Na2SiO3,则C中溶液中变浑浊
C.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生沉淀后沉淀又溶解
D.实验仪器D可以起到防止溶液倒吸的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知28 g CuO和MgO的固体混合物与200 mL某H2SO4溶液恰好完全反应,将反应后的溶液小心蒸干,得到固体68 g。则原H2SO4溶液的物质的量浓度和原固体混合物中氧元素的质量分数分别是( )
A.2.5 mol·L-1 28.57%B.2.2 mol·L-1 23.07%
C.1.5 mol·L-1 24.55%D.2.5 mol·L-1 18.37%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现实验室需要用质量分数:98%、密度:1.84g/cm3的浓硫酸配制240mL4.6mol/L的稀硫酸,下列说法中正确的是( )
A.该浓硫酸的物质的量浓度为18.4mol/L
B.需要该浓硫酸的体积为60mL。
C.配制稀硫酸时,将量好的浓硫酸注入容量瓶中,并加入适量的水
D.该同学实际配制得到的浓度为4.8mol/L,可能的原因是量筒量取浓硫酸时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析比较氧化铁和氧化亚铁的性质:
(1)写出下列反应的化学方程式:
①氧化铁与一氧化碳反应______________________;
②氧化铁与铝发生铝热反应____________________;
③氢气还原氧化亚铁________________________;
④氧化亚铁在高温下转化为四氧化三铁_____________________。
(2)上述各反应中氧化铁或氧化亚铁表现的氧化性或还原性:
①___________________;②____________________;
③___________________;④_____________________。
(3)从铁元素的化合价分析说明:
①氧化铁具有的性质_______________________________。
②氧化亚铁具有的性质_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A.能使甲基橙变红的溶液中:Na+、Al3+、Br-、CH3COO-
B.![]() =1×10-12的溶液中:K+、Na+、CO
=1×10-12的溶液中:K+、Na+、CO![]() 、Cl-
、Cl-
C.0.1mol·L-1NaHSO3溶液中:Na+、NH![]() 、ClO-、MnO
、ClO-、MnO![]()
D.0.1mol·L-1Fe(NO3)3溶液中:Cu2+、Fe2+、SCN-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)如下图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6 mol/L的硫酸,其他试剂任选。填写下列空白。
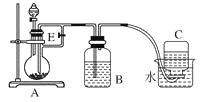
(1)B中盛一定量的NaOH溶液,A中应预先加入的试剂是____________,A中反应的离子方程式是:_________。
(2)实验开始时就先将活塞E______(填“打开”或“关闭”),C中收集到气体的主要成分是________。
(3)简述生成Fe(OH)2的操作过程________________。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年科学家提出“绿色自由”构想。把空气中的CO2进行转化,并使之与H2反应生成可再生能源甲醇。
(1)工业生产中可利用H2还原CO2制备清洁能源甲醇。
①下列关于氢能的说法正确的是____。
A.氢能是清洁能源 B.氢能是二次能源
C.氢能是不可再生能源 D.气态氢能源更容易保存和运输
②已知CO(g)和H2(g)的燃烧热(△H)分别为-283.0kJmol-1、-285.8kJmol-1。CO与H2合成甲醇的能量变化如图甲所示:
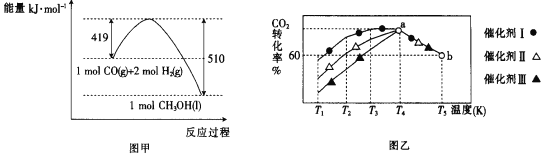
则用CO2(g)和H2(g)制备液态甲醇的热化学方程式为____。
③将一定量的CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率与温度的变化如图乙所示:催化效果最好的是催化剂____(选填“Ⅰ”“Ⅱ”或“Ⅲ”)。
(2)利用CO和水蒸气可生产H2,反应的化学方程式:CO(g)+H2O(g)CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行如下反应,得到三组数据如表所示:
温度/℃ | 起始量 | 达到平衡 | |||
CO/mol | H2O/mol | H2/mol | CO转化率 | 时间/min | |
650 | 4 | 2 | 1.6 | 10 | |
900 | 3 | 2 |
| 5 | |
900℃时,达到平衡时的反应速率v(H2O)=____。(保留2位小数)。
(3)科学家还研究了其他转化温室气体的方法,利用如图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为____。
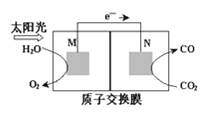
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com