
| A. | 为了增加食物的营养成分,可以大量使用食品添加剂 | |
| B. | 加碘盐是食盐中加入碘单质 | |
| C. | 石英可用于生产光导纤维 | |
| D. | 从海水中提取物质都必须通过化学反应才能实现 |
分析 A.大量使用食品添加剂对人体有害;
B.加碘盐中碘元素以碘酸钾形式存在;
C.二氧化硅具有良好的光学特性;
D.从海水中可以提取氯化钠.
解答 解:A.大量使用食品添加剂对人体有害,如防腐剂等,故A错误;
B.加碘盐是食盐中加入碘酸钾,故B错误;
C.石英主要成分是二氧化硅,二氧化硅具有良好的光学特性,是制造光导纤维主要成分,故C正确;
D.从海水中提取蒸馏水和盐时,通过蒸馏、蒸发等物理变化就能实现,提取溴、碘、镁等物质时,必须通过化学反应才能实现,故D错误;
故选:C.
点评 本题考查食品添加剂的使用、硅及其化合物用途、物理变化与化学变化等,题目不大,明确物理变化化学变化的区别是解题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径大小:S2->Cl->Na+>Al3+>F- | |
| B. | 热稳定性大小:SiH4>PH3>NH3 | |
| C. | 相同条件下与水反应的剧烈程度:Rb>K>Na>Li | |
| D. | 酸性强弱顺序:HClO4<H2SO4<H3PO4<H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可在分液漏斗内用四氯化碳萃取碘酒中的碘单质 | |
| B. | 分液漏斗在使用前只需检查旋塞芯处是否漏水即可 | |
| C. | 在分液漏斗中加入萃取剂后应上下颠倒摇匀使萃取剂与溶质充分接触 | |
| D. | 放出下层液体时,应打开上方的玻璃塞,并使下端管口紧贴烧杯内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Mg2+、NO${\;}_{3}^{-}$、Na+ | B. | H+、Br-、CO${\;}_{3}^{2-}$、K+ | ||
| C. | Fe2+、K+、OH-、SO${\;}_{4}^{2-}$ | D. | H+、Na+、NO3-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
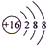 .A+、C2-、D-中离子半径最小的是Na+.(用具体离子符号表示)
.A+、C2-、D-中离子半径最小的是Na+.(用具体离子符号表示)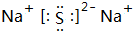 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com