
(1)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500°C生成白磷,反应为:
2Ca3(PO4)2+6SiO2===6CaSiO3+P4O10
10C+P4O10===P4(白磷)+10CO
每生成1 mol P4时,就有________mol电子发生转移。
(2)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
□Ce3++□H2O2+□H2O===□Ce(OH)4↓+□________。
解析:(1)反应过程中磷酸钙最终变成了白磷,磷的化合价由+5价变成0价,由此可以得到 如下关系式:2Ca3(PO4)2~P4~20e-,所以每生成1 mol P4,转移20 mol电子;
如下关系式:2Ca3(PO4)2~P4~20e-,所以每生成1 mol P4,转移20 mol电子;
(2)分析反应可知,C e元素化合价由+3升高到+4,H2O2中氧元素化合价由-1降低到-2,根据得失电子守恒可确定Ce3+的化学计量数为2,H2O2的化学计量数为1,再根据电荷守恒可知缺少的物质为H+,最后根据原子守恒配平。
e元素化合价由+3升高到+4,H2O2中氧元素化合价由-1降低到-2,根据得失电子守恒可确定Ce3+的化学计量数为2,H2O2的化学计量数为1,再根据电荷守恒可知缺少的物质为H+,最后根据原子守恒配平。
科目:高中化学 来源: 题型:
(1)1 mol分子式为C3H8O的液体有机物A,与足量的金属钠作用,可生成11.2 L氢气(标准状况),则A的分子式必有一个__________基。若A分子中只有一个—CH3,完成(2)(3)中的填空:
(2)A与浓硫酸共热,分子内脱去1分子水,生成B。B的结构简式为__________。B通入溴水能发生__________反应生成C,C的结构简式为__________。A在有铜作催化剂时,与氧气一起加热,发生氧化反应,生成D,D的结构简式为__________。
(3)写出下列反应的化学方程式:
①A―→B_____________________________________________;
②B―→C_____________________________________________;
③A―→D_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O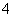 )
)
D.pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )
A.1∶4 B.1∶2
C.2∶1 D.4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
在反应11P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO4中,每摩尔CuSO4能氧化P的物质的量为( )
A.1/5 mol B.2/5 mol
C.3/5 mol D.11/5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于苯酚的叙述中,正确的是( )
A.苯酚呈弱酸性,能使石蕊试液显浅红色
B.苯酚分子中的13个原子有可能处于同一平面上
C.苯酚有强腐蚀性,沾在皮肤上可用酒精洗涤
D.苯酚能与FeCl3溶液反应生成紫色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
绿色化学对化学反应提出了“原子经济性” 的新概念及要求。理想的原子经济性反应是原料分子中的原子全部转化成所需要的产物,不产生副产物,实现零排放。下列几种生产乙苯的方法中,原子经济性最好的是(反应均在一定条件下进行) ( )
A.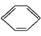 +C2H5Cl
+C2H5Cl
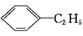 +HCl B.
+HCl B. +C2H5OH
+C2H5OH
 +H2O
+H2O
C. +CH2
+CH2 CH2
CH2

D.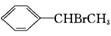

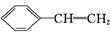 +HBr
+HBr
 +H2
+H2

查看答案和解析>>
科目:高中化学 来源: 题型:
锶(Sr)为第五周期ⅡA族元素,其化合物六水氯化锶(SrCl2·6H2O)是实验室重要的分析试剂,工业上常以天青石(主要成分为SrSO4)为原料制备,生产流程如下:
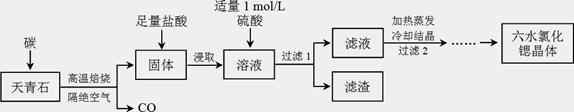
已知:① 经盐酸浸取后,溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质;
② SrSO4、BaSO4的溶度积常数分别为3.3×10-7、1.1×10-10;
③ SrCl2·6H2O的摩尔质量为:267 g/mol。
(1)天青石焙烧前先研磨粉碎,其目的是_________________________________________。
(2)隔绝空气高温焙烧,若0.5 mol SrSO4中只有S被还原,转移了4 mol电子。写出该反应的化学方程式:_____________________________________________。
(3)为了得到较纯的六水氯化锶晶体,过滤2后还需进行的两步操作是_______________。
(4)加入硫酸的目的是______________________。为了提高原料的利用率,滤液中Sr2+的浓度应不高于_________ mol/L(注:此时滤液中Ba2+浓度为1×10-5 mol/L)。
(5)产品纯度检测:称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×10-2 mol的AgNO3溶液(溶液中除Cl―外,不含其它与Ag+反应的离子),待Cl―完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+ 以AgSCN白色沉淀的形式析出。
① 滴定反应达到终点的现象是_________________________________________。
② 若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为______________(保留4位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com