
硅单质及其化合物应用很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下 :
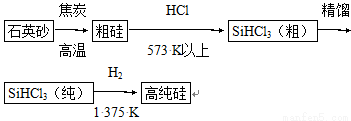
①写出由纯SiHCl3制备高纯硅的化学反应方程式____________________。
②整个制备过程必须严格控制无水、无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式____________________;H2还原SiHCl3过程中若混有O2,可能引起的后果是____________________。
(2)下列有关硅材料的说法正确的是 ( )。
A.单质硅化学性质稳定,但可以被强碱溶液腐蚀
B.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
C.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
D.光导纤维的主要成分是SiO2
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入盐酸,振荡。写出实验现象并给予解释(用化学方程式说明)_________________________ ____。
(4)在人体器官受到损伤时,需要使用一种新型无机非金属材料来植入体内,这种材料是________(填字母)。
A.高温结构陶瓷 B.生物陶瓷 C.导电陶瓷
(1)①SiHCl3+H2 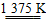 Si+3HCl
Si+3HCl
②SiHCl3+3H2O=H2SiO3+H2↑+3HCl↑
高温下,H2遇O2可能会引起爆炸;O2可能会氧化SiHCl3
(2)AD
(3)生成白色絮状沉淀,Na2SiO3+2HCl=2NaCl+H2SiO3↓
(4)B
【解析】①SiHCl3和H2在高温下反应得到高纯硅的同时,可得到HCl,因此化学方程式为SiHCl3+H2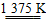 Si+3HCl,②SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,不难得出另一种物质为氢气,从而写出反应化学方程式,当混有氧气时,氢气和氧气会发生反应,可能会引起爆炸,另外,氧气也可能会氧化SiHCl3;(2)A、D比较简单,属于正确的说法,B中,单晶硅性质稳定,能与氢氟酸反应,而不能与盐酸反应,所以这一说法是错误的;C中要注意玻璃是混合物,不具备固定的熔沸点,所以C错误;(3)用盐酸制取硅酸,由于硅酸不溶于水,所以可以看到有白色絮状沉淀产生,反应化学方程式为Na2SiO3+2HCl=2NaCl+H2SiO3↓;(4)因是植入人体内,因此选用生物陶瓷,故选择B。
Si+3HCl,②SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,不难得出另一种物质为氢气,从而写出反应化学方程式,当混有氧气时,氢气和氧气会发生反应,可能会引起爆炸,另外,氧气也可能会氧化SiHCl3;(2)A、D比较简单,属于正确的说法,B中,单晶硅性质稳定,能与氢氟酸反应,而不能与盐酸反应,所以这一说法是错误的;C中要注意玻璃是混合物,不具备固定的熔沸点,所以C错误;(3)用盐酸制取硅酸,由于硅酸不溶于水,所以可以看到有白色絮状沉淀产生,反应化学方程式为Na2SiO3+2HCl=2NaCl+H2SiO3↓;(4)因是植入人体内,因此选用生物陶瓷,故选择B。


科目:高中化学 来源:2014年高二化学人教版选修二 模块综合检测练习卷(解析版) 题型:选择题
下列物质与其用途相符合的是 ( )。
①N2—保护气 ②SiO2—光导纤维 ③AgI—人工降雨
④碘—预防甲状腺肿大 ⑤Al2O3—耐火材料 ⑥NaClO—消毒剂
A.②③④⑤⑥ B.①②③④⑤
C.②③④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修二 3单元综合检测练习卷(解析版) 题型:选择题
下列关于新型有机高分子材料的说法中,不正确的是( )。
A.高分子分离膜应用于食品工业中,可用于浓缩天然果汁、乳制品加工、酿造业等
B.复合材料一般具有强度高、质量轻、耐高温、耐腐蚀等优异性能,其综合性能超过了单一材料
C.导电塑料是应用于电子工业的一种新型有机高分子材料
D.合成高分子材料制成的人工器官都受到人体的排斥作用,难以达到生物相容的程度
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修二 3.2 金属材料练习卷(解析版) 题型:填空题
如图所示水槽中试管内有一枚铁钉,放置数天后观察:
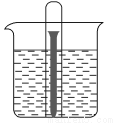
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于________腐蚀。
(2)若试管内液面上升,则原溶液呈________性,发生________腐蚀,电极反应式为:负极:____________________,正极:____________________。
(3)若试管内液面下降,则原溶液呈________性,发生________腐蚀。电极反应式为,负极:____________________,正极:____________________。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修二 3.2 金属材料练习卷(解析版) 题型:填空题
钢铁工业对促进经济和社会发展起了重要作用。
(1)炼铁高炉分为五部分,铁矿石与高温煤气主要在________部分发生反应,在________部分开始生成生铁和炉渣。
(2)炼钢时,除磷的化学方程式为____________________;加入硅、锰和铝的目的是________________________。
(3)不锈钢含有的Cr元素是在炼钢过程的氧吹________(填“前”或“后”)加入,原因是______________________。
(4)炼铁和炼钢生产中,尾气中均含有的主要污染物是________。从环保和经济角度考虑,上述尾气经处理可用作________。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修二 3.1 无机非金属材料练习卷(解析版) 题型:计算题
普通玻璃中,Na2SiO3、CaSiO3、SiO2的物质的量之比是Na2SiO3∶CaSiO3∶SiO2=1∶1∶4。
(1)若以aNa2O·bCaO·mSiO2形式表示此玻璃的组成,则a∶b∶m=____________。
(2)若要制备1 000 kg上述玻璃,需要原料各多少千克?共可产生标准状况下的CO2气体多少升?
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修二 2单元综合检测练习卷(解析版) 题型:选择题
海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:

(1)请列举海水淡化的两种方法:________、________。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、________、________或H2、________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为___________ _____________________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_________________________,
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是______________________________。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59 ℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:
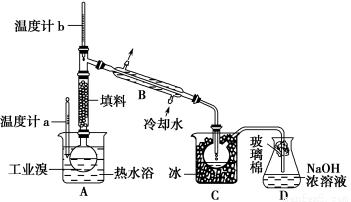
请你参与分析讨论:
①图中仪器B的名称:____________________________________________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是_________ ________________________________________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:_________________________________。
④C中液体产物颜色为________,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是_____________________。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修二 2.3 石油煤天然气利用练习卷(解析版) 题型:选择题
为了更好地解决能源问题,人们一方面研究如何提高燃煤的燃烧效率,另一方面寻找能源,以下做法不能提高燃烧效率的是 ( )。
A.煤的气化与液化 B.液体燃料呈雾状喷出
C.通入大量的空气 D.将煤粉碎
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修二 1.3 纯碱的生产练习卷(解析版) 题型:填空题
纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:___________________________。
(2)写出“联合制碱法”有关反应的化学方程式:_______________________
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?_______________________。
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应列出计算原子利用率的表达式:原子利用率(%)=_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com