
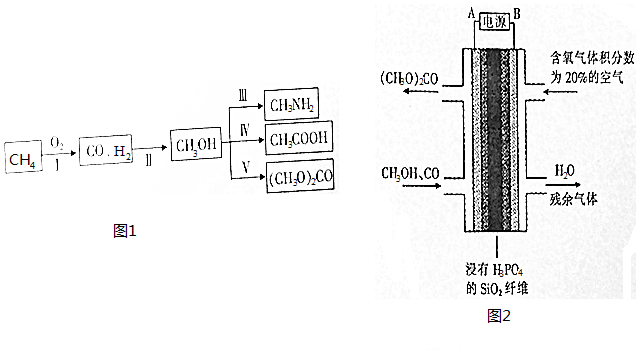
分析 (1)由反应物和生成物可知,反应有单质参加和生成;
(2)平衡常数为生成物与反应物浓度幂之积的比值;升高温度、增大浓度、压强以及加入催化剂等可增大反应速率,提高CO转化率,应使平衡正向移动;
(3)CH3NH3Cl为强酸弱碱盐,水解呈酸性;
(4)CH3COOAg与HI反应生成AgI,生成沉淀,应满足Qc>Ksp;
(5)采用气相甲醇电化学法制备碳酸二甲酯,阳极发生氧化反应,甲醇被氧化,阴极氧气得到电子生成水.
解答 解:(1)由反应物和生成物可知,反应有单质参加和生成,为置换反应,故答案为:置换反应;
(2)①平衡常数为生成物与反应物浓度幂之积的比值,K=$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})c(CO)}$,故答案为:K=$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})c(CO)}$;
②a.使用高效催化剂,平衡不移动,转化率不变,故a错误;
b.降低反应温度,反应速率减小,故b错误;
c.升高反应温度,平衡逆向移动,转化率减小,故c错误;
d.增大体系压强,平衡正向移动,且反应速率增大,转化率增大,故d正确;
e.及时将CH3OH从反映混合物中分离出来,浓度减小,反应速率减小,故错误.
故答案为:d;
(3)CH3NH3Cl为强酸弱碱盐,水解呈酸性,溶液中离子浓度大小关系为c(Cl-)>c[CH3NH3+]>c(H+)>c(OH-),故答案为:c(Cl-)>c[CH3NH3+]>c(H+)>c(OH-);
(4)CH3COOAg与HI反应生成AgI,方程式为CH3COOAg(s)+HI=CH3COOH+AgI(s),生成沉淀,应满足Qc>Ksp,但不能说明溶度积大小,
故答案为:CH3COOAg(s)+HI=CH3COOH+AgI(s);不能;
(5)①采用气相甲醇电化学法制备碳酸二甲酯,阳极发生氧化反应,甲醇被氧化,电极方程式为2CH3OH+CO-2e-=(CH3O)2CO+2H+,
故答案为:2CH3OH+CO-2e-=(CH3O)2CO+2H+;
②正极上氧气得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O,当电路中转移1.0mol电子时,消耗0.25mol氧气,体积为5.6L,则空气的体积为$\frac{5.6L}{0.2}$=28.0L,
故答案为:28.0.
点评 本题考查较为综合,涉及化学平衡、离子 大小比较以及电解等知识,为高考常见题型,侧重考查学生的分析能力和计算能力,注意把握平衡常数以及电解池的工作原理,难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油干馏可得到汽油、煤油等 | |
| B. | 苯不能使酸性KmnO4溶液褪色,因此苯不能发生氧化反应 | |
| C. | 淀粉、蛋白质完全水解的产物互为同分异构体 | |
| D. | 乙酸乙酯、油脂与NaOH溶液反应均有醇生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的气化和液化是物理变化 | |
| B. | 煤的干馏是在隔绝空气条件下进行的 | |
| C. | 大量燃烧煤炭是造成雾霾的重要原因 | |
| D. | 发展“煤制油”工程可减少对石油产品的依赖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时,Zn板应与外接电源的负极相连 | |
| B. | 放电时,溶液中的OH从正极向负极移动 | |
| C. | 正极反应式为:FeO42-+3e-+4H2O═Fe(OH)3+5OH- | |
| D. | 充电时,当转移0.2mol电子时,阴极质量增加3.4g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com