
| A. | 氢氧化钠溶液、盐酸都为强电解质 | |
| B. | 铁生锈、食物腐败都涉及有氧化还原反应 | |
| C. | 漂白粉、冰醋酸、氢氧化铁胶体均为混合物 | |
| D. | 二氧化氮、二氧化硅都是酸性氧化物 |
分析 A.水溶液中或熔融状态下完全电离的电解质为强电解质;
B.铁生锈与食物腐败均属于缓慢氧化;
C.不同物质组成的为混合物;
D.酸性氧化物是与碱反应只生成盐和水的氧化物.
解答 解:A.盐酸属于混合物,既不是电解质也不是非电解质,故A错误;
B.食物腐败与铁生锈均属于缓慢氧化,都涉及有氧化还原反应,故B正确;
C.漂白粉是氯化钙和次氯酸钙的混合物、冰醋酸是一种物质组成的纯净物、氢氧化铁胶体为混合物,故C错误;
D.二氧化硅和碱反应生成盐和水属于酸性氧化物,二氧化氮和碱反应发生氧化还原反应,不是酸性氧化物,故D错误;
故选B.
点评 本题考查了物质分类、物质性质和组成、氧化物类别判断等,掌握基础是解题关键,题目难度不大.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| A. | 离核近的区域运动 | B. | 离核远的区域运动 | ||
| C. | 无法确定运动区域离核远近 | D. | 化学变化中较难失去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4H+C→CH4 | B. | CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+5H2O | ||
| C. | CaO+H2O=Ca(OH)2 | D. | CO2(g)→CO2(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D、E、F、G为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb;C元素对应单质是空气中含量最多的物质;D的最外层电子数是内层电子数的3倍;E与D同主族,且位于D的下一周期;F与E同周期,且是本周期中电负性最大的元素:基态G原子核外电子填充在7个能级中,且价层电子均为单电子.
A、B、C、D、E、F、G为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb;C元素对应单质是空气中含量最多的物质;D的最外层电子数是内层电子数的3倍;E与D同主族,且位于D的下一周期;F与E同周期,且是本周期中电负性最大的元素:基态G原子核外电子填充在7个能级中,且价层电子均为单电子.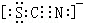 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,5.6g Fe与足量Cl2充分反应转移电子总数为0.2NA | |
| B. | 密闭容器中2molNO与1molO2充分反应后,容器内气体的分子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| D. | 1 L 0.lmol•L-1的CH3COONa溶液中CH3COO-和CH3COOH粒子数之和为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
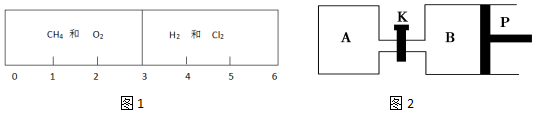
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X 的化学式为AgS | |
| B. | 每生成1molX会转移2 mol电子 | |
| C. | 反应中Ag、H2S均是还原剂 | |
| D. | 银针验毒时,空气中的氧气发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com