
【题目】【化学―选修5:有机化学基础】
聚碳酸酯(PC)是一种强韧的热塑性树脂,广泛用于玻璃装配业、汽车工业、电子和电器工业。PC的一种合成路径如下:
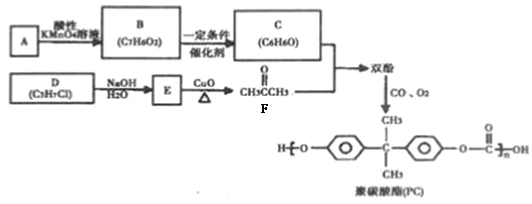
回答下列问题:
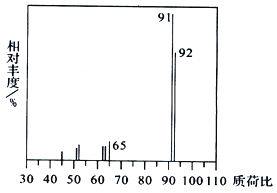
(1)烃A 的质谱图如下,则A 的分子式为__________。
(2)D 的名称为_________,D→E的反应类型为_______。
(3)双酚的结构简式为_______。
(4)B 和E 可以形成一种酯类物质F,写出B + E→F反应的化学方程式:_______。
(5)F的同分异构体中,能同时满足如下条件的共有______种(不考虑立体异构)。
① 分子中有两个甲基;
② 能发生银镜反应;
③ 在酸性溶液中的水解产物遇FeC13 溶液显紫色。
写出其中核磁共振氢谱显示5组峰,且峰面积比为62:2:11的种分子的结构简式:_______。
(6)写出由D分子合成甘油(丙三醇)的合成路线图_______。(已知:![]() )
)
【答案】 C7H8 2-氯丙烷 取代反应 
 13
13 

![]()
【解析】(1)92÷12=7……8,所以A的分子式为C7H8,根据产物PC的结构可知A的结构简式为![]() ,名称为甲苯。
,名称为甲苯。
(2)C3H7Cl为卤代烃,在NaOH的水溶液中发生水解生成相应的醇,醇在CuO氧化下生成(CH3)2C=O,由此可知氯原子连接在中间碳上,所以D的结构简式为(CH3)2CHCl,名称为2—氯丙烷,D到E的反应类型是取代反应或水解反应。
(3)A是甲苯,在KMnO4的氧化下生成B,B为苯甲酸,苯甲酸在一定条件下还原为C,根据C的分子式可知C为苯酚,两分子苯酚与丙酮发生反应生成双酚,丙酮中碳氧双键断开,苯酚中酚羟基对位的氢原子断裂,形成H2O,因此双酚的结构简式为: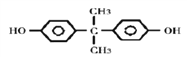 。
。
(4)B为苯甲酸,D的结构简式为(CH3)2CHCl,E的结构简式为(CH3)2CHOH,B与E发生酯化反应,化学方程式为: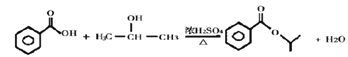 。
。
(5)F的分子式为C10H12O2,不饱和度为5,在酸性溶液中的水解产物遇FeC13溶液显紫色,
可知含有一个苯环(不饱和度为4)和一个酯基(不饱和度为1),且羟基氧连在苯环上。能发生银镜反应,含有一个醛基,根据不饱和度可知该物质只能是甲酸某酯,除去苯环和甲酸某酯上的7个碳外,还余3个碳,含有两个甲基,则有两种情况:(1)一个甲基和一个乙基分别连在苯环上,此时F结构中苯环上连着3个不同的取代基,共有10种结构;(2)苯环上连着一个异丙基-CH(CH3)2,此时F结构中苯环上连着2个取代基,共有3种结构,故符合条件的同分异构体总共有13种;根据峰峰面积比为6:2:2:1:1可知F结构中含有异丙基结构,故符合条件的同分异构体的结构为 。
。
(6)比较原料2-氯丙烷和目标产物丙三醇的结构可知,官能团的种类、数目发生变化,要得到丙三醇必须先制取三氯丙烷,要使一氯丙烷转化为三氯丙烷,必须通过加成反应增加氯原子,所以先使2 –氯丙烷在NaOH的醇作用发生消去反应得到丙烯,然后在加热下取代-CH3上的一个H原子,然后再与Cl2发生加成反应,即可引入3个氯原子的卤代烃,最后水解即可,故其合成路线为: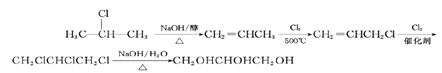 。
。


科目:高中化学 来源: 题型:
【题目】高锰酸钾在化学实验中是一种常用的氧化剂,某化学兴趣小组拟在实验室制备KMnO4并测定其纯度。
Ⅰ.KMnO4的制备
步骤1:利用下图所示装置制备K2MnO4
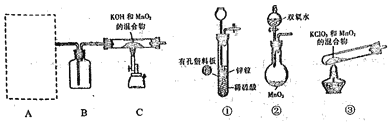
(1)装置A应选用_______( 填"①","②"或"③"),装置B中盛装的试剂是_______。
(2)装置C中反应生成K2MnO4的化学方程式为_________。
步骤2:由K2MnO4制备KMnO4
已知:①3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
②相关物质的溶解度数据见下表:

实验流程如下:
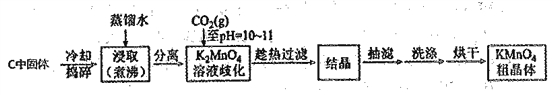
(3)结合相关物质的化学性质及溶解度,可以替代CO2的试剂是______________。
A.亚硫酸氢钾 B.稀硫酸 C.稀盐酸 D.稀醋酸
(4)当溶液pH达10~11时,停止通CO2;若CO2过量,会因生成____而使其和产品一起析出
(5)证明K2MnO4歧化完全的方法:取上层清液少许于试管中,通入CO2,若________,证明K2MnO4歧化完全。
Ⅱ.KMnO4纯度的测定
(6)通过用草酸(二元弱酸)滴定酸化后的KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数)。
①滴定过程中发生反应的离子方程式为__________________。
②称取 w g KMnO4粗产品配制100mL待测溶液,量取KMnO4待测液10.00mL于锥形瓶中进行实验,进行三次平行实验后测得平均消耗c mol/L草酸标准液V mL,则样品纯度的表达式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R、M、N是7种短周期元素,原子序数依次增大。已知X组成的单质是密度最小的气体,Y是形成化合物种类最多的元素,W原子最外层电子数是次外层电子数的3倍,R、M、N处于同一周期,R是该周期中金属性最强的元素,R与N能形成化合物RN,M与W同一主族。
请回答下列问题:
(1)Z在周期表中的位置是________________;N的原子结构示意图是____________。
(2)X、Y形成含碳量最小的有机物分子的空间构型是_____________。
(3)X、W、N按照原子个数比1∶1∶1形成的化合物的电子式为_____________。
(4)W与R形成的化合物R2W2可作供氧剂,该化合物含有的化学键类型有: _________,该化合物与YW2反应的化学方程式是__________________________________________________________。
(5)在一定条件下,往M的氢化物的水溶液中通入N的单质,出现混浊,则该反应的化学方程式是_________。此反应可证明单质氧化性M___________N(填“>”、“<”或“=”)。
(6)以上几种元素任意组合,可形成的酸性最强的物质是________________________,可形成的碱性最强的物质是_______________________(填写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基于CaSO4为载氧体的天然气燃烧是一种新型绿色的燃烧方式,CaSO4作为氧和热量的有效载体,能够髙效低能耗地实现CO2的分离和捕获其原理如下图所示:
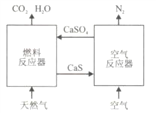
(1)已知在燃料反应器中发生如下反应:
i.CaSO4(g)+CH4(g)=4CaO(s)+CO2(g)+4SO2(g)+2H2O(g) ΔH1=akJ/mol
ii.CaSO4(s)+CH4(g)=CaS(s)+CO2(g)+2H2O(g) ΔH2=bkJ/mol
ⅲ. CaS(s)+3CaSO4(s)= 4CaO(s)+4SO2(g) ΔH3=ckJ/mol
①燃料反应器中主反应为_____________(填“i”“ ii”或“ⅲ”)。
②反应i和ii的平衡常数Kp与温度的关系如图1,则a_____________ 0(填“>”“ =” 或“<”);720℃时反应ⅲ的平衡常数Kp=_________________。
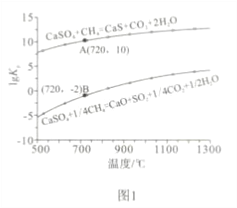

③下列措施可提高反应ii中甲烷平衡转化率的是______________ 。
A.增加CaSO4固体的投入量 B.将水蒸气冷凝
C.降温 D.增大甲烷流量
(2)如图2所示,该燃料反应器最佳温度范围为850℃-900℃之间,从化学反应原理的角度说明原因:
________________________。
(3)空气反应器中发生的反应为
CaS(s) +2O2(g)=CaSO4(s) ΔH4=dkJ/mol
①根据热化学原理推测该反应为 __________________(填“吸热”或“放热”) 反应。
(4)该原理总反应的热化学方程式为_____________________________。
(5)25℃时,用Na2S沉淀Cu2+、Sn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如右图所示,请回答:

25℃时向50mL的Sn2+、Cu2+浓度均为0.01 mol/L的混合溶液中逐滴加入Na2S溶液,当Na2S溶液加到150mL时开始生成SnS沉淀,则此时溶液中Cu2+浓度为___________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境污染已严重危害人类的生活。下列对应关系正确的是
选项 | 环境问题 | 造成环境问题的主要物质 |
A | 温室效应 | CO2 |
B | 酸雨 | O3 |
C | 南极臭氧层空洞 | SO3 |
D | 光化学烟雾 | N2 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A. 用KIO3氧化酸性溶液中的KI:5I—+IO3—+3H2O==I2+6OH—
B. 向NH4HCO3溶液中加过量Ba(OH)2溶液并加热:NH4++OH—![]() NH3↑+H2O
NH3↑+H2O
C. 在海带灰的浸出液(含有I—)中滴加H2O2得到I2:2I—+H2O2+2H+==I2+2H2O
D. 用浓硝酸洗涤试管内壁的银镜Ag+2H++NO3—==Ag++NO↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d是四种短周期元素,a、b、d同周期,c、d同主族,a的原子结构示意图为:![]() ,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构。下列比较中,正确的是( )
,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构。下列比较中,正确的是( )
A. 原子序数:a>b>c B. 元素的非金属性:d>a>c
C. 原子半径:c>a>d D. 最高价含氧酸的酸性:d>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题:
(1)以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池中:
①H+向___________极移动(填“正”或“负”)。
②电子流动方向由____________极流向____________极(填:“正”、“负”)。
③若有1mol e- 流过导线,则理论上负极质量减少____________g。
④若将稀硫酸换成硫酸铜溶液,电极质量增加的是___________(填“锌极”或“铜极”),原因是_____________(用电极方程式表示)。
(2)一定温度下,在容积为2 L的密闭容器中进行反应:aN(g) ![]() bM(g) +cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
bM(g) +cP(g),M、N、P的物质的量随时间变化的曲线如图所示:

①反应化学方程式中各物质的系数比为a∶b∶c=_________。
②1 min到3 min这段时刻,以M的浓度变化表示的平均反应速率为:________________________。
③下列叙述中能说明上述反应达到平衡状态的是____________________________。
A.反应中当M与N的物质的量相等时
B.P的质量不随时间变化而变化
C.混合气体的总物质的量不随时间变化而变化
D.单位时间内每消耗a mol N,同时消耗b mol M
E.混合气体的压强不随时间的变化而变化
F.M的物质的量浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液X中只可能溶有K+、Mg2+、Al3+、AlO![]() 、SiO
、SiO![]() 、SO
、SO![]() 、CO
、CO![]() 、SO
、SO![]() 中的若干种离子。某同学对该溶液进行了如下实验。则下列判断正确的是
中的若干种离子。某同学对该溶液进行了如下实验。则下列判断正确的是

A. 气体甲一定是纯净物
B. 沉淀甲是硅酸和硅酸镁的混合物
C. K+、AlO![]() 和SiO
和SiO![]() 一定存在于溶液X中
一定存在于溶液X中
D. CO![]() 和SO
和SO![]() 一定不存在于溶液X中
一定不存在于溶液X中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com