
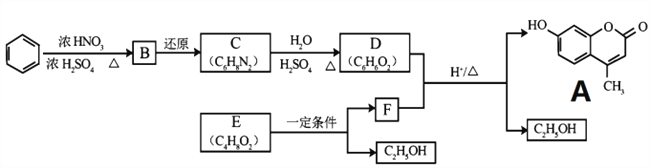
【题目】有机物A 的合成路线如下,E 属于酯类,F 的组成为 C6H10O3。
已知 1: R1COOR2+CH3COOC2H5![]() R1COCH2COOC2H5+R2OH
R1COCH2COOC2H5+R2OH
已知 2: RCOOR'+R'OH![]() RCOOR'+R'OH
RCOOR'+R'OH
已知 3: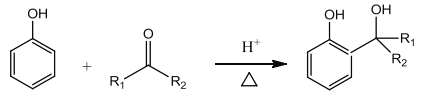
回答下列问题:
(1)B 的结构简式是________,C→D 的反应类型是_______。
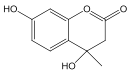
(2)D 和 F 为合成 A 分为三步反应完成,依次写出 D 和 F合成 A 的两种中间产物的结构简式_____、_______。
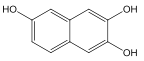
(3)写出符合下列条件的 A 的任意一种同分异构体的结构简式________。
①不发生水解反应;②遇氯化铁溶液呈紫色;③1mol 可消耗 3molNaOH;④有两个六元环
(4)设计以乙醇为原料制备 F 的合成路线(用流程图表示,无机试剂任选)_________。
【答案】 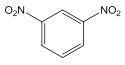 取代反应
取代反应 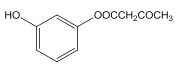 或
或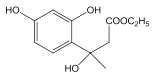
 (或
(或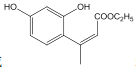 )
)  (羟基位置可以任意, 合理答案都给分)
(羟基位置可以任意, 合理答案都给分) ![]()
![]()
![]()
【解析】试题分析:由题中信息可知,B为间二硝基苯,C为间苯二胺,D为间苯二酚,E为乙酸乙酯,F为CH3COCH2COOC2H5。
(1)B 的结构简式是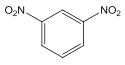 ,C→D 的变化中,官能团由氨基变为羟基,反应类型是取代反应。
,C→D 的变化中,官能团由氨基变为羟基,反应类型是取代反应。
(2)D 和 F 为合成 A 分为三步反应完成, 依据题中的信息2和信息3可知,D 和 F之间可能先发生取代反应生成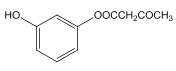 ,也可能先发生加成反应生成
,也可能先发生加成反应生成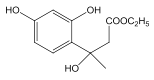 ,然后它们分别转化为
,然后它们分别转化为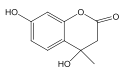 和
和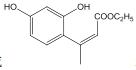 ,最后它们分别转化为A。
,最后它们分别转化为A。
(3)A 的同分异构体符合下列条件:①不发生水解反应,说明分子中没有酯基;②遇氯化铁溶液呈紫色,说明分子中有酚羟基;③1mol 可消耗 3molNaOH,说明有3个酚羟基;④有两个六元环。符合条件的同分异构体有多种,例如: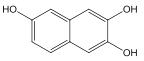 (羟基位置可以任意)。
(羟基位置可以任意)。
(4)以乙醇为原料制备 F (CH3COCH2COOC2H5),首先把乙醇氧化为乙醛,然后把乙醛氧化为乙酸,接着乙醇和乙酸发生酯化反应生成乙酸乙酯,最后,乙酸乙酯发和分子间的取代生成F,具体合成路线如下:![]()
![]()
![]() 。
。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①检测乙醇中是否含有水可加入少量的无水硫酸铜,若变蓝则含水 ②除去乙醇中微量的水可加入金属钠,使其完全反应 ③获得无水乙醇的方法是直接加热蒸馏 ④乙酸与乙醇酯化反应时断裂碳氧键
A.①③B.②④C.①④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z 四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是
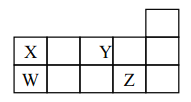
A. 四种元素中原子半径最大为 W, Y 的氢化物稳定性最强
B. 四种元素最高价氧化物的水化物都是酸
C. XZ4、 WY2中所含化学键类型相同,熔点都很高
D. W、 X 形成的单质都是重要的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是四种短周期元素,X原子M层上的电子数是原子核外电子层数的2倍;Y原子最外层电子数是次外层电子数的2倍;Z元素的单质为双原子分子,Z的氢化物水溶液呈碱性;W元素最高正价是+7价。回答下列问题:
(1)元素X原子结构示意图为________。
(2)元素Y的最高价氧化物的结构式为__________,其中一种同位素可测定文物年代,这种同位素的符号是________。
(3)元素Z能与氢元素形成-1价阴离子为_________,该阴离子的电子总数是________。
(4)元素W的单质与元素X的低价氧化物在水溶液中反应的离子方程式为___________。
(5)ZW3常温下呈液态,可与水反应生成一种具有漂白性的酸和一种碱性气体,反应的化学方程式为_______。
(6)探寻物质的性质差异性是学习的重要方法之一。X、Y、Z、W四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是_______(用酸的分子式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 填空:
(1)写出表示含有8个质子、10个中子的原子的化学符号:_________。
(2)元素周期表中位于第8纵行的铁元素属于_________族。
(3)元素周期表中最活泼的非金属元素位于第_________纵行。
(4)所含元素超过18种的周期是第_________周期。
II. 4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。
m | n | ||
x | y |
(1)元素x在周期表中的位置是第________周期、第________族。
(2)四种元素最高价氧化物的水化物中,酸性最强的是_____,碱性最强的是_____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁屑为原料制备三草酸合铁(Ⅲ)酸钾(K3[Fe(C2O4)3])的化学方程式依次为:
①Fe(s)+H2SO4=FeSO4+H2↑
②FeSO4+H2C2O4+2H2O = FeC2O4·2H2O↓+H2SO4
③2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O
已知: K3[Fe(C2O4)3]·3H2O 易溶于水, 难溶于乙醇。
回答下列问题:
(1)在反应①得到的 FeSO4溶液中, 需加入少量 H2SO4酸化, 目的是_________。
(2)为从反应③后的溶液得到 K3[Fe(C2O4)3]晶体, 某同学设计的实验步骤为: “加热蒸发—冷却结晶 —抽滤—洗涤 —干燥 ”,请评价该方案的合理性,并说明理由____________。
(3)为从反应③后的溶液中得到 K3[Fe(C2O4)3]·3H2O 晶体,请再设计另外一种实验方案(不要求写具体的实验操作)_______________。
(4)过滤K3[Fe(C2O4)3]·3H2O晶体有关的操作正确的是_______。
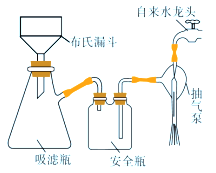
A.选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸
B.放入滤纸后,直接用倾析法转移溶液和沉淀,再打开水龙头抽滤
C.洗涤晶体时,先关闭水龙头,用蒸馏水缓慢淋洗,再打开水龙头抽滤
D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,以防倒吸
(5)称取 5.00g 制得的晶体加水溶解,配成 250mL 溶液,取 25.00mL 于锥形瓶中,用0.100mol·L-1 酸性高锰酸钾标准溶液滴定,重复三次实验,平均消耗 12.00mL。 计算所得的样品中K3[Fe(C2O4)3]·3H2O的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铁及其化合物在合金材料以及催化剂等方面应用广泛。
(1)Fe3+的电子排布式为___________________。已知,Fe3+的化学性质比Fe2+稳定,请从原子结构的角度进行解释_____________________________________________________。
(2)Fe能与CO形成配合物Fe(CO)5,1 mol Fe(CO)5中含有________ mol σ键
(3)与CO互为等电子体的分子和离子分别为_______和_______(各举一种即可,填化学式)
(4)已知某铁晶体的晶胞结构如图所示。
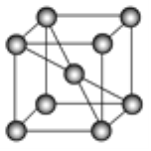
①该晶胞中含有铁原子的数目为___________。
②若晶胞的边长为a cm,则晶体铁的密度为_______________________g·cm-3(用代数式表示,阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图。若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是

A. X的最常见气态氢化物的水溶液显碱性
B. 最高价氧化物对应水化物的酸性W比Z强
C. Z的单质与氢气反应比Y单质与氢气反应剧烈
D. X的原子半径小于Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室保存下列物质的方法中,不正确的是( )
A.少量金属钠保存在煤油里
B.浓硫酸存放在广口试剂瓶中
C.FeSO4溶液存放在加有少量铁粉的试剂瓶中
D.氯水应装在棕色细口瓶中密封避光保存
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com