
| A、使甲基橙变红的溶液中:Ag(NH3)2+、H+、Na+、NO3- |
| B、0.1 mol?L-1 Fe3+溶液中:Cl-、SO42-、K+、C6H5OH |
| C、“84”消毒液的水溶液中:K+、Cl-、Na+、OH- |
| D、通入过量SO2气体的溶液中:K+、NO3-、Ba2+、Cl- |


科目:高中化学 来源: 题型:
| A、钠在水层中反应并四处游动 |
| B、钠停在苯层中不反应 |
| C、钠在苯的液面上反应并四处游动 |
| D、钠在苯与水的界面处反应并可能上下跳动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、NH4+、Cl-、CH3COO- |
| B、K+、Fe2+、SO42-、NO3- |
| C、Na+、K+、CO32-、ClO- |
| D、Al3+、Cu2+、SO42-、HS- |
查看答案和解析>>
科目:高中化学 来源: 题型:
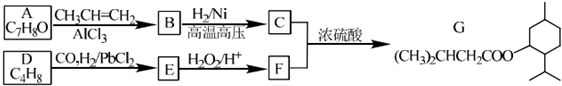
| PbCl2 |


| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
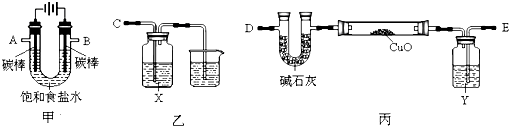
 | 方案甲 | 方案乙 |
| U型管+固体 | 硬质玻璃管+固体 | |
| 反应前质量/g | a | c |
| 完全反应后质量/g | b | d |
查看答案和解析>>
科目:高中化学 来源: 题型:
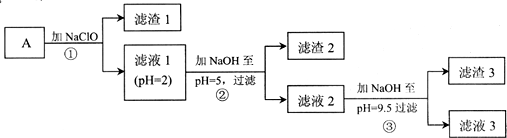
| 物质 | 开始沉淀的pH | 沉淀完全的pH | Kap(25℃) |
| Fe(OH)3 | 2.7 | 3.7 | 4.0×10-38 |
| Fe(OH)2 | 7.6 | 9.6 | 8.0×10-16 |
| Ni(OH)2 | 7.2 | 9.2 | 5.5×10-16 |
| Mg(OH)2 | 9.6 | 11.1 | 1.2×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K2CO3 |
| B、BaCl2 |
| C、CH3COONa |
| D、Na2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com